Mell – a rák megbetegedése és kezelése
Robin Smithuis, Janneke de Bes és Anneke Zeillemaker
Alrijne kórház radiológiai és sebészeti tanszéke, Leiderdorp Hollandiában
A képalkotás fontos szerepet játszik a mellrák kimutatásában és felállításában, valamint a monitorozásban.
A mellrák gyorsan változó kezelésének korában fontos ismerni a bejáratási osztályozást, és tudatában kell lennie a rendelkezésre álló sebészeti, radioterápiás és onkológiai kezelési lehetőségeknek annak érdekében, hogy releváns információt szolgáltasson, és így optimalizálja a betegellátást
Ez a cikk egy áttekintést nyújt a mellrák kialakulásáról és kezeléséről.
Ne feledje, hogy helyi különbségek vannak a kezelési stratégiákban, és hogy az új célzott terápiák jelenleg kidolgozás alatt állnak.
Staging és kezelés áttekintése 1
Ez egy sematikus illusztráció a mellrákos betegek bejáratánál és kezelésében.
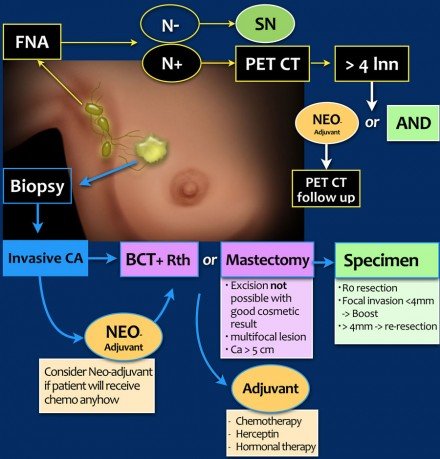
- A mellrákos betegek először klinikailag előkészítettek, ami cTNM színpadot eredményez. A kezeléstervezést egy multidiszciplináris csoportban tárgyalják.
- Sok beteg esetében a műtét lesz a következő lépés. Gyakran növekszik a neoadjuváns kemoterápia a tumorterhelés csökkentése érdekében a műtét előtt.
- A műtétet követően a patológus analizálja a műtéti mintákat (tumor, szondin csomó vagy axilláris csomópontok a boncolás után).
Ez pTNM szakaszhoz vezet. A neoadjuváns terápia után hozzáadódik az y betű, amelyet ypTNM-színpadnak neveznek. - A pTNM- vagy ypTNM-stádium alapján a multidiszciplináris csoportban további adjuváns kemoterápiás, radioterápiás és hormonális vagy HER-2 célzott terápiás kezelést folytatunk.
- c – klinikai
- p – patológia
- y – post neoadjuváns terápia
Minden kép kinagyítható a nagyításhoz.
Staging és kezelés áttekintése 2
Ez a tábla a mellrákos betegek stagingját és kezelését mutatja vázlatosabb módon.
cTNM
A mellrák először klinikailag előkészített.
A cTNM leírja a mell (T) helyi beavatkozását, a regionális nyirokcsomókat (N) és a szisztémás betegséget, azaz távoli metasztázisokat (M). A szisztémás betegség (vagy a 4. stádiumú betegség) nem szerepel a táblázatban.
Ez a DCIS, a lokalizált rák, a lokoregionálisan előrehaladott rák és a távoli metasztázisok által okozott rák lehetséges diagnosztizálását eredményezi.
A “klinikai” kifejezés a klinikai TNM-szakaszban kissé zavaró lehet.
Lehet, hogy azt gondolják, hogy ez a beosztás nagyrészt a fizikális vizsgálat eredményein alapul, de leginkább a képalkotó és a képpel vezérelt biopszia eredményein alapul.
Neoadjuváns kemoterápia
A neoadjuváns kemoterápiát (a neo: előtt és adjuvare: a segítséghez) olyan lokoregionálisan előrehaladott rákos betegek kapják, akik csökkentik a tumorterhelést a műtét előtt.
Helyi rákos betegeknél, akiknél az adjuváns terápia jelzése (lásd az adjuváns terápia alatti táblázatot), a terápia a műtét előtt (neo-adjuváns) vagy műtét után (adjuváns) adható.
Sentinel csomópont
Azoknál a betegeknél, akiknél nem észlelhető kimutatható axilláris nyirokcsomó áttétek ultrahanggal vezérelt finom tűs aspirációval (FNA), az axin csomópont eljárást hajtanak végre annak érdekében, hogy információt szerezzenek a tengely nyirokcsomó állapotáról.
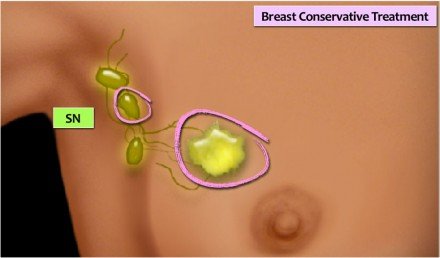
Melltartó terápia vagy mastectomia
A BCT-t akkor végezzük, amikor a kivágás jó kozmetikai eredménnyel lehetséges. A műtétet mindig sugárkezelés követi.
A jó kozmetikai eredmény a daganat méretétől és a mell méretétől függ.
Napjainkban a nagyobb tumorok kezelésére BCT-vel műanyag- és rekonstruktív műtétet alkalmazhatunk a zsírpótlással és a flap-eljárásokkal.
Ha a BCT nem lehetséges – vagy a páciens akarata -, akkor a masztektómia elvégezhető.
Sugárkezelés
A kezelést a végső szakaszban és a tumor jellemzőiben tervezik.
Az adjuváns szisztémás kemoterápia és az endokrin terápia komplementer kezelési lehetőségek az elsődleges lokoregionális kezelés után. Ezek célja a távoli okkult metasztázisok eltávolítása, amelyek jelen lehetnek, de még nem mutathatók ki.
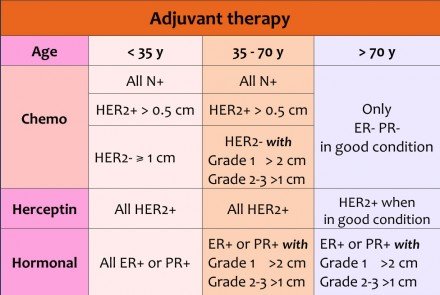
Az adjuváns terápia kemoterápiából és / vagy herceptinből és / vagy hormonterápiából állhat.
A terápia megválasztása a következőktől függ:
- A beteg kora
- A daganat mérete
- Nyirokcsomó állapot
- A daganat minősége
- Ösztrogén, progeszteron és HER 2-neu receptorok
A ductalis carcinoma in situ a leggyakoribb nem invazív emlőrák.
In situ jelentése “a helyén“és utal arra, hogy a rák nem mozdult ki a csatornából, és nem infiltrált a környező szövetekben.
A DCIS fejlődhet invazív rákká, de a valószínűségi becslések változóak.
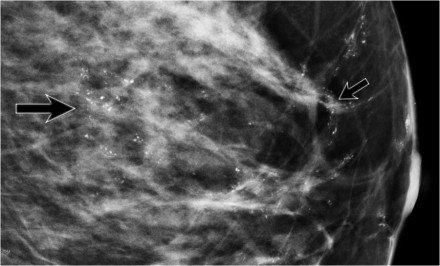
A DCIS 80% -át egyedül mammográfiával diagnosztizálják mikrocikalizálódások alapján (ábra), majd vákuumszűrős biopsziával. A DCIS nagyon kevés esete látható tapintóként.
A DCIS-vel kapcsolatos probléma:
-
A DCIS méretét a mikrokriifikációval rendelkező terület nagysága határozza meg, de ez gyakran alulbecsült. Ennek eredményeképpen a DCIS-ben a reszekció sebessége magasabb, mint a DCIS nélküli invazív rák.
A DCIS-vel diagnosztizált betegek 15-20% -ában invazív rákot találtak a patológus a resected mintában. Ez gyakrabban fordul elő a DCIS II. És III. Fokozatában. Ezeket a betegeket invazív rákkal kell kezelni.
E problémák miatt elővigyázatosságos MRI-t végeznek a magas fokú DCIS-szel rendelkező esetekben egyes intézményeknél, a daganat terjedésének pontosabb meghatározására és annak felmérésére, hogy vannak-e invazív növekedés jelei.
Hogy ez a beteg javát szolgálja, még mindig nem tisztázott.
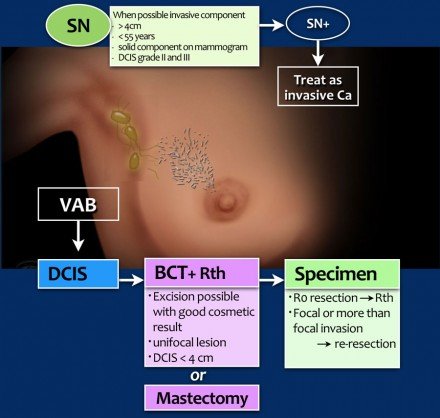
DCIS kezelése
(BCT) vagy mastectomia, attól függően, hogy a kivágás lehetséges-e jó kozmetikai eredménnyel, és persze a betegek preferenciáján.
BCT
mikroszkopikusan teljes tumor kivágás és radioterápia áll. A sugárterhelést figyelembe lehet venni, különösen fiatalabb betegeknél.
Sentinel csomópont eljárás
fontolóra kell venni további invazív karcinóma esetén (lásd a táblázatot).
Mintadarab
Ha a DCIS teljes mértékben resected, ezt R0-resectio-nak hívják.
A mellmegtartó műtét után ezeket a betegeket radioterápiával kezelik.
Ha a reszekciós margók fokális inváziója van, akkor extra lendületet kapunk.
Ha több mint a fókuszos invázió (> 4 mm) van, akkor ismételt reszekciót vagy mastectomiát hajtanak végre.
Tanulmányozza a képeket, majd folytassa az olvasást.
Kattints a képre a nagyításhoz.
Az eredmények a következők:
- Több gyanús meszesedés a mell nagy szegmensében.
- Több klaszter – sok a lineáris elágazási elrendezéssel – jellemző a DCIS számára.
A meszesedéssel járó nagy terület miatt egy mastectomiát terveztek.
A DCIS becsült mérete miatt egy őrző csomópont eljárást is végrehajtottak.
Ha egy mastectomiát terveznek, az SN-eljárást rutinszerűen bevonják, mert ezt nem lehet később elvégezni.
A patológiában az invazív rák kis gerincét mutatták.
Ebben a betegben a gyanús meszesedések két csoportja van, amelyek körülbelül 5 cm-re vannak egymástól.
Először a nagyobb csoport biopszia volt.
Az ötlet az volt, hogy ha ezek a meszesedések jóindulatúak, akkor a kisebb klaszter valószínűleg jóindulatú is lehet.
Azonban a kalcifikációk nagyobb csoportja a DCIS 2. fokozatnak bizonyult.
Tehát egy második biopsziára volt szükség a meszesedés kisebb csoportjára, és ez szintén DCIS 2. fokozatnak bizonyult.
Szervező csomópontú masztektómia tervezett.
A DCIS teljes területét túlságosan nagynak tartották az emlőrák kezelésére.
Lokális emlőrák
A lokalizált vagy korai stádiumú emlőrák a következőket tartalmazza:
A tumor receptorállapotától függően a helyi rákos betegek többsége adjuváns vagy neoadjuváns kezelést is kap.
Csak a régebbi betegek (> 70 év) vagy a kisméretű, alacsony fokú daganatoknál 70 évnél fiatalabb betegeknél nincs szükség kemoterápiára (lásd a táblázatot).
Nincs szükség további vizsgálatokra a lokalizált emlőrákban, mivel a metasztatikus betegség kialakulásának esélye nagyon alacsony.
Locoregionális fejlett rák
A lokálisan előrehaladott emlőrák:
- T3: tumorok> 5 cm
- T4: tumorok a bőr vagy mellkasi fal behatolásával
- N2-3: ⩾ 4 axilláris nyirokcsomó vagy ipsilaterális supraclavicularis, infraklavicularis vagy belső emlőcsomók bekapcsolódása
Kezelés
A múltban ezek a daganatok az inoperábilis mellrákkal szinonimák, de ez megváltozott a neoadjuváns terápia bevezetése után.
Ezeket a betegeket először neoadjuváns kemo- és / vagy hormonterápiával kezelik. Ha jó reagál a neoadjuváns terápiára, a következő lépés a műtét, és néha emlőmegtartó műtét is lehetséges.
A neoadjuváns terápia megkezdése előtt egy kapcsot helyeznek a tumorba. Néha a válasz annyira jó, hogy nem maradt daganat.
Jelenleg vita van arról, hogy ezek a páciensek még műtétre szorulnak-e, de jelenleg a betegek többségét BCT-vel kezelik (lumpectomia a klipen, majd radioterápia).
Sebészet és egyéb eljárások
A hónalj nyirokcsomói FNA
Az ultrahanggal irányított FNA vagy a hónalj nyirokcsomó biopsziájának elvégzésére vonatkozó kritériumok a következők:
- Cortex> 2,3 mm, a csomópont pólusain nem mérve.
- A zsíros hilum eltűnése.
- A kéreg aszimmetrikus kidudorodása.
Huzal lokalizáció
A DCIS és sok kis daganat nem tapintható. Ezekben az esetekben a radiológus elhelyez egy horogvezetéket a területre, amelyet el kell távolítani.
A vezetéket a DCIS vagy a DCIS területére helyezzük, akár az USA által vezetett vagy sztereotaktív módon.
Az Egyesült Államokban a tumor helyzete a bőrön van jelölve, míg a beteg a karját ugyanolyan helyzetben tartja, mint a műtét során. Megjegyezzük a daganat pontos mélységét is a bőr alatt.
Az ábrán a drótháló (sárga nyíl) látható a tumor felé (piros nyíl). Vegye észre a fekete pontot a bőrön, hogy pontosan meghatározza a tumor pontos helyzetét.
Az ívelt nyíl jelöli a vezeték bejutását a mellébe.
Sentinel csomópont
Az érzéki csomópont-eljárás (SLN) vált a szokásos módszerré a axilla felállítására olyan emlőrákos betegeknél, akiknek negatív axilláris ultrahangja (cN-) volt.
Az SLN biopszia pontos bejárási információt ad, miközben elkerüli a teljes axilláris nyirokcsomó disszekciójának morbiditását.
Egy festékkel együtt egy radiopharmint injektálunk a tumorba vagy annak közelében (ábra). Ezek a tracerok a nyirokcsatornákon át keresztüljutnak a nyirokcsomókba.
A tracerek befogadására szolgáló első nyirokcsomó (ka) t eltávolítják.
Általában körülbelül három csomópontot távolítanak el. Több mint három SLN eltávolítása nem növeli a pozitív csomópontok pontosságát.
A melltartó kezelés (BCT) más néven lumpectomia vagy széles kivágás. A daganat lokoregionális kivágását egy axilláris csomópont-stádiumban lévő sentinel csomópont-eljárással kombinálják, amelyet a mell mellkasi sugárkezelése követ, vagy lassítás nélkül.
MRI-kompatibilis klipeket kell elhelyezni a tumorágyban a radioterápia pontosságának megszerzése érdekében.
Az ismételt kivágás akkor jelenik meg, ha több mint egy gyulladásos tumor-pozitív reszekciós határ (lásd patológia) van.
A BCT rezsikciós különbségei
- R0-kivágás
Nincsenek daganatok a rezekciós margón. - Fokális nem radikális
A reszekciós határ kevesebb mint 4 mm-e daganatot tartalmaz. - Több mint fókusz
A szélesség több mint 4 mm.
Invazív rák
Az újra kivágás akkor jelezhető, ha a daganatosan pozitív reszekciós határnál több mint fókuszált, mivel ez a legfontosabb kockázati tényező a lokális kiújuláshoz.
Ha a rezekciós határ csak fókuszban van, akkor a sugárzási dózis módosítása jó alternatíva lehet az újra kivágásnak.
DCIS
A kezelés a DCIS-ben agresszívebb, mivel a reszekciós margók bármilyen beavatkozásakor az újra-kivágás vagy mastectomia javasolt.
A mell eltávolítása
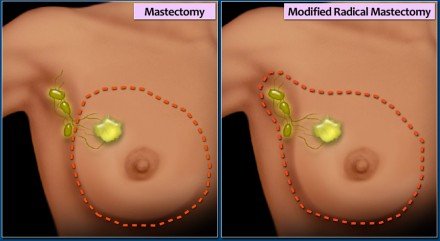
Egyszerű mastectomia
Az egész mell eltávolítása. Egyes axilláris nyirokcsomók (I. szint) is eltávolíthatók.
Módosított radikális mastectomia
A mell, a legtöbb vagy az összes hónalj nyirokcsomóját és a mellkasfal izomzatát eltávolítják.
A pectoralis izom nem távolítható el.
Köldökcsillapító mastectomia
A legtöbb esetben a mellbimbót eltávolítják masztectomiában.
A mellbimbó megmenthető, ha:
- A daganat> 2 cm-re van a mellbimbótól
- Tumorméret
Onkopoplasztikus műtét
Közvetlen rekonstrukció
Közvetlen mell rekonstrukció implantátumokkal.
Diep-szárny
A mélyen gyengébb epigasztrikus artériás perforátor (DIEP) fedőlap egy gyakori technika, amelyben a bőrt és a szubkután zsírt a hasból veszi fel, hogy újra létrehozza a mellet.
SGAP szárny
A kiváló gluteális artériás perforátor (SGAP) fedőlapja a fenék tetejétől szövetet használ, hogy mellszövetet hozzon létre. Ezt általában akkor kell elvégezni, ha a betegek nem rendelkeznek megfelelő bőrt és szövetet a hasüregében, vagy korábbi hasi műtéteket végeztek.
TRAM szárny
A pedikuláris TRAM fedélen a szövet marad az eredeti helyén, megtartva vérellátását.
A bőr, a zsír és az izom vérellátását biztosító szárny alagút alatt van a bőr alá a mellkasra.
Axilláris nyirokcsomó-disszekció
Az axilláris nyirokcsomó-disszekcióban (ALND) a hónalj nyirokcsomói eltávolításra kerülnek.
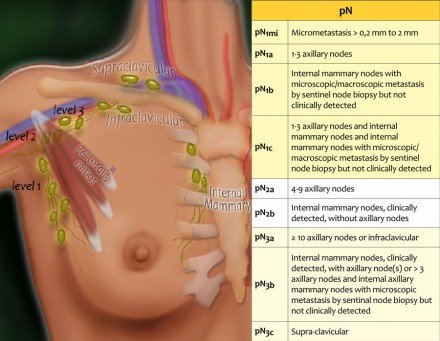
A hónalj nyirokcsomóinak három szintje van:
Az I. szint a pectoralis minor izom alsó széle alatt helyezkedik el.
A II. Szint a pectoralis minor szintjén van.
A III. Szint a pectoralis minor felett van.
Az ALND-szintekben az I és II szinteket eltávolítjuk.
Napjainkban a sebészek megpróbálják elkerülni az ALND-t azáltal, hogy egy őrszem csomópontos disszekciót hajtanak végre, vagy a neilágyiás terápiával lefelé irányítják a tengelyt.
Az ALND-t akkor hajtják végre, ha sok pozitív csomópont van, vagy ha a neoadjuváns terápia nem lehetséges.
MARI eljárás
A MARI eljárás egy új, minimális invazív módszer a neoadjuváns szisztémás kezelés után a hónalj nyirokcsomó metasztázisának kóros reakciójának felmérésére.
A daganat-pozitív axilláris nyirokcsomót radioaktív jód (I) maggal jelöltük.
Ez a jelzett nyirokcsomó az úgynevezett MARI-csomópont.
Neoadjuváns kezelés után a MARI csomópontot szelektíven eltávolítjuk γ-detektáló szondával.
Ha a csomó tumor-negatív lett és az őrszem csomópont szintén negatív, a axilla további kezelésére nincs szükség.
Ez a módszer lehetővé teszi axilla-megóvó műtétet olyan betegeknél, akik jól reagálnak a neoadjuváns kezelésre.
A sebészi beavatkozást követően a patológus elemzi a tumor sebészi mintáit, az érzéki csomópontot vagy az axilláris csomópontokat. Ez egy pTNM-lépést eredményez (táblázat).
A pTNM eltérhet a cTNM-fázisból, és néha az eredeti kezelési tervet módosítani kell.
Például ha egy resected minta margója nem daganatmentes, akkor szükség lehet a radioterápia újra kivágására vagy módosítására.
A megfelelő kóros pT-osztályozáshoz nem lehet brutális tumor a resectiós margókban.
A besorolás a margókban mikroszkópos daganattal lehetséges.
A tumor mérete csak az invazív komponenst foglalja magában.
Ha van egy nagy in situ komponens (például 4 cm) és egy kis invazív komponens (például 0,5 cm), akkor a daganatot 0,5 cm-rel meg kell mérni és kódolni kell a pT1a-t.
A tumor sebészi mintájának, az őrző csomópontnak vagy a hónaljcsomóknak a patológus általi disszekció után történő elemzése a pTNM vagy a ypTNM-stádiumot eredményezi.
Más tumor jellemzőket is vizsgálnak, mint például a tumor fokozatú, a hormonreceptorok, a nyirokcsomó-invázió és a génexpresszió, mivel ezek a jellemzők meghatározzák a helyi kiújulás és szisztémás betegség kockázatát is.
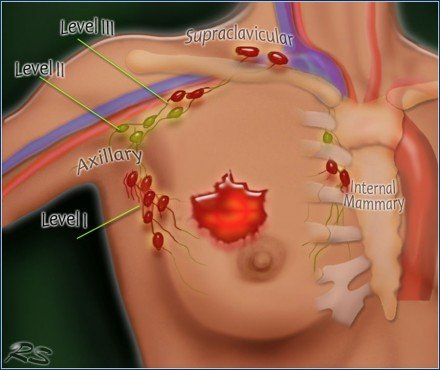
A mell nyirokelvezetésének 75 százaléka a hónalj csomópontja.
Az 1. szintű csomópontok a pectoralis minor izom alsó széle alatt helyezkednek el.
A 2. szintű csomópontok a pectoralis minor izom szintjén helyezkednek el.
A 3. szint a pectoralis minor izom felett van, és az infra- és supraclavicularis csomópontokba áramlik.
A nyirokcsomók kisebb része a belső emlőcsomókban, vagy kevésbé gyakori módon átjut a transzpektorális úton.
YPN stádiumú
A neoadjuváns kemoterápiát kapó betegeknél a nyirokcsomó állapotát befolyásolja.
Emiatt a y adunk a pN-fázisba. Például, ha egy őrző csomópont-eljárást végeznek a neoadjuváns terápia után, és 3 pozitív csomópont található a patológiában, ez egy ypN1a-t eredményez.
Tumor-osztályozás
A tumor szövettani fokozata egy másik fontos prognosztikai tényező a daganat kialakulásában.
A magas fokú daganatosodás nagyobb valószínűséggel terjed, és agresszívabb adjuváns terápiát igényel.
A tumorosztályozás a módosított Bloom és Richardson irányelvei szerint történik, és a tubulusképződés, a nukleáris polimorfizmus és mitotikus aktivitás teljes pontszámán alapul.
Génkifejezés
A mellrákos betegek prognózisa és kezelése számos tényezőtől függ:
- TNM-stádium.
- Tumor fokozat
- Lymphangio-invázió
- Hormon receptorok
- A tumor gén expressziója
A daganat DNS-jének és a génexpressziónak a vizsgálata olyan emlőcarcinomi altípusok azonosításához vezetett, amelyek különféle klinikai kimeneteleket és különböző kemoterápiás válaszokat tartalmaznak.
Segíthet olyan betegek kiválasztásában, akiket agresszíven kell kezelni, és akik nem.
A génkifejezés egy olyan folyamat, amelyben egy gén bekapcsolódik egy sejtbe, hogy RNS-t és fehérjéket hozzon létre.
Néhány ilyen fehérje, például HER2 / neu, stimulálja a tumorsejtek növekedését.
HER-2 / neu
Ezt a fehérjét abnormálisan nagy mennyiségben állítják elő az emlőtumorok körülbelül 20% -ában. A HER2-t túltermelő emlőrák általában agresszívabb és valószínűbb, hogy megismétlődik.
A trasztuzumab (Herceptin) kifejezetten a HER2 fehérjét célozza meg, és az adjuváns kemoterápiával együtt 50% -kal csökkentheti a megismétlődés kockázatát, ha csak a kemoterápiára vonatkoznak.
Ha a mellrák újraszáfordul vagy elterjed, a rákos sejteket újra kell vizsgálni a HER2 és a hormon receptor állapot szempontjából, mivel ezek az esetek legfeljebb 20-30% -ától eltérhetnek az eredeti ráktól (8).
Mammaprint
A génexpressziós minták alapján az emlőrák különböző molekuláris altípusokra vagy profilokra bontható.
Az egyik ilyen profil a MammaPrint®, amely 70 különböző daganatgént tesztel, és osztja a betegeket egy magas és alacsony kockázatú kategóriába, és hogy a betegek részesülnek-e a kemoterápiában, vagy sem.
Szisztémás terápia
Adjuváns szisztémás terápia
Az adjuváns szisztémás kemoterápiát és az endokrin terápiát a primer lokoregionális kezelés kiegészítéseként adják be, azzal a céllal, hogy eltávolítsák az esetleges távoli okkult metasztázisokat (amelyek jelen lehetnek, de még nem mutathatók ki).
Az adjuváns terápia lehet kemoterápia, herceptin és / vagy hormonterápia.
A HER2 / neu pozitív és hormonterápiában szenvedő betegek kemoterápiájához hozzáadott Herceptin adása olyan betegeknek adható, akik ösztrogénre vagy progeszteronreceptorokra (ER + vagy PR +) rendelkeznek,
Az idősebb nőknél, akik ER + vagy PR + néha csak hormonterápiát kapnak a betegség stabalizálásának megpróbálásakor.
Neoadjuváns terápia
A neoadjuváns kemoterápiát vagy primer szisztémás kezelést kizárólag a lokálisan előrehaladott betegségben szenvedő betegeknél adták be, azaz a III. És a II. Stádiumú, nagy tumoros betegek (T3N0) esetében.
A jelenlegi politika szerint egyre több, korai rákbetegségben szenvedő, kemoterápiás javallatot mutató beteg, neoadjuváns kemoterápiával kezelik az adjuváns kezelés utáni műtét helyett.
Ennek a politikának az előnye, hogy a neoadjuváns terápia lehetővé teszi a kezelésre adott válasz monitorozását, így a kemoterápia típusát akkor lehet beállítani, ha nincs megfelelő válasz.
Egy másik előny, hogy a lumpectomium mérete csökkenthető, és az emlőrző kezelés lehetséges olyan betegeknél, akik egyébként masztektómia kezelésben részesültek volna.
Még a klinikai komplett remisszióban is a műtét és sugárterápia kombinációját találták a helyi kiújulás elkerülése érdekében.
A neoadjuváns terápia megkezdésének előfeltételei
- Szövettani biopszia: a tumor fokozat meghatározása, hormon receptorok és HER-2 amplifikáció.
- A kezdeti daganatméret és a metasztázisok pontos dokumentálása MRI segítségével, hacsak nem megbízhatóan meghatározható a mammográfia és az ultrahang segítségével.
- Fotó cT4 daganatok a bőrmetasztázisok rögzítéséhez.
- Röntgensugárzó jelölő vagy radioaktív jód-125 mag behelyezése a tumorba, attól függetlenül, hogy a masztektómia vagy a BCT-t választották-e.
- Az axilláris nyirokcsomó klinikai és ultrahangos állapotának rögzítése.
- Ha cN1-3: citológiai megerősítés. Jelölje meg a pozitív nyirokcsomót egy markerrel, vagy helyezzen rá radioaktív jódmagot a neoadjuváns szisztémás kezelés után (axillary staging) (MARI eljárás).
- ha cN0: SWK eljárás. Néhányan előnyben részesítik a neoadjuváns kezelést, mások a kezelést követően.
A távoli metasztázisok szűrése
- A III. Stádiumú mellrákban szerepel
- Tekintsük a II. Stádiumú klinikai N + mellrákot
Neoadjuváns kemoterápia
A neoadjuváns kemoterápia válaszaránya 80-90%.
A progresszió kockázata kevesebb, mint 5-10%. A progresszió esetén nincs egyértelmű kezelési terv, amelyet a kemoterápia során a RECIST> 20% -os átmérőjének növekedése határoz meg.
Neoadjuváns hormonterápia
Nem állnak rendelkezésre véletlen besorolásos vizsgálatok, amelyek összehasonlítják a neoadjuváns hormonterápiát ugyanazzal a kezeléssel, mint műtét után. A kemoterápiához hasonlóan a neoadjuváns hormonális terápia úgy tűnik, hogy a hormonreceptor-pozitív tumorok esetében lecsökkentette a lefolyását, és a III. Vagy a BCT-ben a radikális műtétek nagyobb esélyei mutatkoztak, amikor a masztektómia kezdetben szükségesnek mutatkozott.
Neoadjuváns trasztuzumab
A trastuzumab neoadjuváns kemoterápiához való hozzáadása növeli a patológiás teljes válasz százalékos arányát.
Sugárkezelés
Az emlő sugárkezelése
A radioterápia a mellrákban végzett emlőrző kezelés szerves részét képezi. A BCT után bekövetkező ismétlődés a maradék daganatok növekedésének tulajdonítható.
Az egész emlőt sugárterheli a daganatos ágyon adott választható dózis növelésével.
A kis és alacsony fokú DCIS-es betegeknél a recidívás kockázata alacsony, és a további radioterápia nem igazolható (15).
A mellkason sugárterápia
A mellkasi fal sugárkezelésére utaló jelek a mastectomia után:
- Az elsődleges daganat tumor-pozitív rezekciós határa.
- T4 tumor
- pT3, a következő kockázati tényezők közül egy vagy több függvényében: angioinvazív növekedés, 3. fokozatú daganat és / vagy életkora <40 év
A tengely sugárkezelése
Az axilláris sugárterápia biztonságos alternatíva a hónalj nyirokcsomó-műtéthez, és kisebb a limfedema kockázata.
Nagyon sok vita van a tengely sugárkezelésére utaló jelekkel kapcsolatban.
Sok iránymutatás nem bizonyítékokon alapul.
A megközelítések különböznek egymástól az országok és az intézmények között.
A Duthc Breast Cancer Guideline 2012-ben a jelzések a következők (1):
- Elkülönített tumorsejtek az őrző csomópontban:
Radioterápia nem ajánlott. - mikrometasztázisokat az SN-ben: A sugárterápiát csak további kockázati tényezők esetén ajánlott alkalmazni.
- makrometasztázisok:
A radioterápia jelzi.
A nagy axilláris tumor terhelés esetén a hónalj nyirokcsomók disszekciója ajánlott.
Ezek az iránymutatások azonban nem vonatkoznak más országokra, és nem is bizonyítékokon alapuló, hanem szakértői vélemények.
Konzisztenciát kell szereznie a sugárterápiás javallatokról a saját intézményében.
Speciális emlőrák típusok
Háromszoros negatív emlőrák
Az emlőrákok körülbelül 15-20% -a úgynevezett hármas negatív, és az ER-, PR- és HER2-overexpresszió hiánya jellemzi.
Ezek a daganatok gyakrabban fordulnak elő fiatal korban, kiváló minőségűek, és gyakran jelentős méretűek a hónalj nyirokcsomóinak metasztázisaiban.
A hármas negatív tumorok gyengébb prognózissal rendelkeznek gyors recidíva és gyakori agyi áttétek esetén.
Tanulmányok kimutatták, hogy ezek a daganatok jobban reagálnak a normál neoadjuváns kemoterápiára az antraciklinekkel és taxánokkal összehasonlítva más tumor típusokkal.
Gyulladásos karcinóma
A gyulladásos karcinóma vagy mastitis carcinoma a mellrák külön kategóriája, és az összes emlőrák 1-5% -át teszi ki.
A diffúz bőrpír, narancshéj és a mell duzzanata jellemzi, ezért főleg klinikai diagnózis.
Ez egy ritka és nagyon agresszív betegség, amelyben a tumor emboli blokkolja a bőr nyirokrendszerét.
A TNM osztályozás a T4D (III. Szakasz).
A bőr és a mellbimbó visszahúzódása nem ugyanúgy, mint a gyulladásos emlőrák, és bármely T-szakaszban előfordulhat anélkül, hogy befolyásolná a besorolását.
Pagett betegség a mellbimbó
A bimbó Paget-betegségének diagnózisát csak akkor lehet elvégezni, ha az alatta lévő mell-parenchyma nem áll fenn.
A Paget-betegséggel kapcsolatos emlõs parenchyma karcinómáit a parenchimális betegség mérete és jellemzõi alapján osztályozzák, bár a Paget-betegség jelenlétét még mindig meg kell jegyezni.
Lobularis karcinóma
Az invazív lobularis karcinóma a második leggyakoribb típusú emlőrák az invazív ductalis karcinóma után (17).
Az invazív lobularis karcinómák sokkal nehezebbek felismerni a mammográfiát, mert a csomók kialakulása helyett a rákos sejtek tipikusan a környező kötőszövetre terjednek ki vonalképződésben.
További képalkotás
Mikor kell PET-CT-t használni?
A locoregionális betegségben szenvedő betegeknél a távoli metasztázisok felkutatására ajánlott PET-CT. A PET-CT nagyobb érzékenységgel és specifikussággal rendelkezik a távoli metasztázisok és lokoregionális ismétlődés kimutatására, mint a hagyományos képalkotás.
A PET-CT érzékenysége azonban túl alacsony az elsődleges emlőrák kimutatására, és a PET-CT nem játszik szerepet klinikailag negatív axilla kialakulásában, és nem tudja helyettesíteni az SN-eljárást.
Ha azonban axilláris nyirokcsomó-áttéteket észlel az FNA vagy a sentinel csomópont-eljárás, és a PET-CT a nyirokcsomókba való felvételt mutatja, akkor ezek a csomópontok pozitívak, mivel a pozitív prediktív érték magas.
Itt egy példa a fejlett mellrákos betegre.
Az USA a mellben 18 mm-es echopoor-léziót mutatott, szabálytalan margókkal és mikrokriókokkal.
Az axilla amerikaiak nyirokcsomót fedeztek fel zsíros hilum nélkül.
FNA-t végeztünk, és mind a tumor, mind a nyirokcsomó pozitív volt az adenokarcinóma számára.
A sérülést klinikailag cT1N + -ként rendeztük. PET-CT-t végeztünk.
A felső PET-CT képen egy II-es szintű csomópont pozitív a pectoralis minor alatt (sárga nyíl).
Többszörös axilláris csomópontokat találtunk, de nem voltak szisztémás metasztázisok.
Normál barna zsír látható a nyak és vállizmok mentén mindkét oldalon (kör).
Ezt a beteget neoadjuváns terápiára tervezték, és a tumor fokozat, a hormon receptorok és a HER-2-neu-amplifikáció meghatározására biopsziákat vettek.
Itt van egy másik PET-CT példa.
A mammográfián egy daganat van másodlagos bőr visszahúzással.
Figyeljük meg a többszörös lineáris meszesedéseket a daganaton belül – kattints a képre a nagyításhoz. Ez azt jelenti, hogy a beszivárgó daganat a ductalis carcinoma in situ vagy a DCIS területén alakult ki.
Az ultrahang tumorfociát mutat a bőrön belül, vagyis a T4b (piros nyíl).
Ezen ultrahang képen egy másik műholdas csomó van a bőrön belül (sárga nyíl).
Többszörös kibővített axilláris csomópontok láthatók (piros nyíl).
A finom tűs aspiráció metasztázisokat mutatott ezeken a csomópontokon belül.
Ezt a tumort T4bN + -ként rendeztük. Ez azt jelenti, hogy lokoregionálisan előrehaladott betegséggel szembesülünk.
Ezek a betegek kockázatot jelentenek a szisztémás betegségekre, és további képalkotást végeztek.
Itt látjuk a beteg PET-CT képét. Mind a mellrák, mind a bőrön való elterjedés (piros nyíllal) igazolható. Mindkét tüdőben több metasztázis van – a jobb tüdő metasztázisát sárga nyíl jelzi; észleljük a nagyobb áttétet a bal tüdőben.
Ráadásul csont- és májmetasztázisokat is észleltek, és többszörös axilláris nyirokcsomókat láttak (ezt nem ábrázolták).
A tumor cTNM-fázisa a T4bN3M1.
Az MRI jobbnak bizonyul a DCIS és az invazív rák méretének jelzésére, és jobb a multifokális vagy kontralaterális betegség kimutatásában. Még vita van a preoperatív MRI szerepéről az emlőrákban szenvedő betegeknél, mivel túlbecslés történik a jóindulatú proliferatív rendellenességek elősegítése miatt.
Sokan nem javasolnak preoperatív MRI-t, mivel ez nem eredményezett jobb eredményt, vagy szignifikánsan alacsonyabb az ismételt működés.
Csak olyan magas fokú DCIS-ben ajánlott, amelyek meghatározatlan daganatméretűek azoknál a betegeknél, akik a BCT-re jogosultak.
Az MRI azonban fontos szerepet játszik a diagnosztikai problémák megoldásában és a magas kockázatú betegek szűrésében.
Az emlõspecifikus gamma-képalkotás (BSGI) kiegészítõ módszert jelent a mellfelvételhez, amely – az MRI-hez hasonlóan – fiziológiai megközelítést alkalmaz a mellek elváltozásainak azonosítására.
Az érzékenység és a specifitás összehasonlítható az MRI-val, és sokkal magasabb, mint a mammográfia esetében – különösen a sűrű mellszövetekben.
A magasabb sugárdózis a mammográfiához viszonyítva nem teszi alkalmassá a BSGI-t a szűrésre, de ez kiváló eszköz a problémamegoldáshoz.
Csakúgy, mint az MRI, jó a multifokális vagy kontralaterális betegség kimutatására.
Sharon H. Giordano
Az Onkológus 2003. december vol. 8no. 6 521-530
Trop I, David J, Lalonde L.
Canoc Assoc Radiol J. 2005, 56 (5): 324-31.
Maaike de Boer et al
N Engl J Med 2009; 361: 653-663
Mieke Kriege et al
N Engl J Med 2004; 351: 427-37.
Marc van de Vijver et al
N Engl J Med 2002, 347: 1999-2009
NICE Clinical Guidelines, No. 80
Donker M1, Straver ME, Wesseling J, Loo CE, Schot M, Drukker CA, van Tinteren H, Sonke GS, Rutgers EJ, Vrancken Peeters MJ.
Ann Surg. Február 2015; 261 (2): 378-82.
Bevezetés a rákterápiához (Sugárzás Onkológia)
A sugárterápia a nagy energiájú sugárzás alkalmazása a ráksejtek DNS-ét okozza, és elpusztítja a szétválasztásra és növekedésre való képességüket. Gyorsítóberendezéssel vagy radioaktív forrásokon keresztül ideiglenesen vagy tartósan elhelyezett gépekkel szállítható. A sugárterápia csökkentheti a fájdalmat és a szenvedést a fejlett rákban szenvedő betegeknél.
A sugárkezelésre való felkészülés a lehető legpontosabban célozza meg a rákos sugárzás dózisát a mellékhatások minimálisra csökkentése és a normál sejtek károsodásának elkerülése érdekében. A képalkotó tesztek segítenek meghatározni a tumor pontos alakját és elhelyezkedését, valamint meghatározni a határait. Kezelőorvosa az elvégzett vizsga típusától függően részletes utasításokat ad.
Röviddel a német fizikus Wilhelm Conrad Roentgen 1895-ben felfedezett röntgensugárzása után az “erőteljes sugárzást” használták a rák kezelésére.
Napjainkban egyre több betegnek sikerült kezelni a rákot, kevesebb mellékhatással és a normál szövetműködés megőrzésével, sugárkezeléssel.
A modern technológia kombinálta a háromdimenziós képalkotó technológia, a számítógépes kezelési tervezés és a nagy energiájú x-ray gépek használatát a pontosabb kezelés érdekében. Azok a szakemberek, akik ezt a technológiát használják, vagy az abból kapott információk:
Kattintson a fent felsorolt radiológiai szakemberekre, ha többet szeretne tudni a specialitásról.
Mi a sugárterápia?
A rákbetegek körülbelül 60% -át sugárzásnak vetették alá bizonyos idő alatt a kezelés folyamán.
A sugárterápia a magas energiájú sugárzás alkalmazása a rák kezelésére. A sugárzás onkológus sugárzást alkalmazhat a rák gyógyítására vagy a rákbeteg fájdalmának enyhítésére vagy a rákos tünetek enyhítésére.
A sugárterápia azért működik, mert a sugárzás elpusztítja a rákos sejtek reprodukciós képességét, és a test természetes módon megszabadul a sejtektől. A sugárzás a rákos sejteket a DNS károsításával érinti, így a rákos sejtek már nem oszthatók el és nem nőhetnek fel. A sugárzás a leghatékonyabb az aktív hatást kiváltó sejtek megölésében. A rákos sejtek két fő oknál fogva érzékenyebbek a sugárzásra: gyorsabban oszlanak el a normál sejteknél, és nem javítják ezt a károsodást annyira, mint a normál sejtek.
A sugárzás onkológus használhatja a külső sugárterápiát, amelyet a lineáris gyorsító (olyan gép, amely felgyorsítja az elektronokat, hogy x-sugarakat vagy gamma-sugarakat állítson elő). Protonterápia egy másik formája a külső sugárterápiának, amely ciklotronokat vagy szinkrotrotokat használ fel olyan töltött atomok előállítására, amelyek tönkreteszik a tumorokat.
A sugárzás radioaktív forrásokból is adható, amelyeket a beteg brachyterápiájába helyeznek. A radioaktív forrásokat tűkön, magvakon, vezetékeken vagy katétereken lezárják, és ideiglenesen vagy tartósan beágyazódnak közvetlenül a tumorba vagy annak közelében. brachyterápia közös kezelés a prosztata rákos megbetegedései, méh, méhnyak vagy mell.
Egyes rákos betegeknél a műtét helyett csak a sugárzás kezelhető. A prosztata rákot és a gége rákot gyakran kezelik ilyen módon.
Néha a sugárkezelés része a beteg kezelésének. Amikor a sugárterápiát műtét után használják, ezt adjuváns kezelésnek nevezik. Például egy nő sugárkezelést kaphat emlőrést követő műtét után. Meg lehet gyógyítani a rákot, és még mindig megtartja a mellét.
A sugárkezelést a műtét előtt is be lehet adni, és ezután neoadjuváns vagy indukciós sugárterápiának nevezhetjük, akár a gyógyulási arány növelése, akár a sebészi beavatkozás megkönnyítése érdekében. E megközelítés példái közé tartozik a nyelőcső, rektális vagy tüdőrák kezelése.
A betegek kezelése sugárkezeléssel és kemoterápiával kezelhető a műtét előtt. A kombinált kezelés lehetővé teheti a páciens számára, hogy kevésbé radikális sebészeti beavatkozást igényel, mint amire egyébként szükség lenne. Például egyes hólyagrákos betegek megtarthatják hólyagukat, ha mindhárom kezelés helyett csak egy kezelést kezelnek. A kemoterápiát a műtét nélküli sugárterápiával egyidejűleg lehet alkalmazni a helyi reakció javítása és a metasztatikus betegségek csökkentése érdekében; ezt kombinált módszernek nevezzük.
Bizonyos esetekben, például tüdő-, fej-, nyak- vagy méhnyakrák esetén az egyetlen kombinált terápia lehet az egyetlen műtét nélküli kezelés.
Mivel a sugárzás károsíthatja a normál sejteket, fontos, hogy a sugárdózis pontosan a rákra irányuljon. A képalkotás segít a kezeléstervezésben is, lehetővé téve a precíz sugárzást, amely a környező, egészséges szöveteket kíméli és minimalizálja a mellékhatásokat és szövődményeket.
A háromdimenziós (3-D) konformális sugárzás fejlett formája, amelyet intenzitás modulált sugárterápiának neveznek IMRT, pontosabban megfelel a dózisnak a daganatokhoz képest, ami lehetővé teszi a hagyományos sugárzási dózisok nagyobb biztonságát. Image-vezérelt sugárterápia vagy IGRT gyakran alkalmazzák intenzitás-modulált sugárterápiával (IMRT) együtt, hogy precíz sugárzási dózist adjanak a rosszindulatú daganatoknak vagy akár a tumor bizonyos területeinek. Az olyan legújabb fejlesztések, mint például az IGRT, lehetővé teszik a testmozgás során a mozgásnak kitett területeken, például a tüdőben és a kritikus szervekhez és szövetekhez közeli tumorok kezelését.
Más technikák, amelyek lehetővé teszik az ultra-precíz dózisokat a sugárzás tumorok közé sztereotaktikus radiokirurgia, amely 3 dimenziós képalkotást használ a daganat pontos koordinátáinak meghatározására. A nagymértékben koncentrált gamma-sugarak vagy röntgensugarak ezután összefonódnak a tumoron a kezeléshez. A Gamma Knife® egy olyan kezelési opció, amely radioaktív kobaltforrásokat használ fel arra, hogy egy sugárzás több sugarát egy kis területre összpontosítson. A lineáris gyorsítók felhasználhatók sztereotaktikus sugárterápiás kezelésre is az agyban. A test más részeit is kezelni lehet, és ezeket sztereotaktikus testradio-terápiának (SBRT) tekintjük. Az SBRT-t használó új területek közé tartozik a tüdő, a máj és a csont.
A sugárzás felhasználható arra is, hogy leválassza a vérképzőszervi daganatok véráramát, például a májban. Például, radioembolization radioaktív izotópokkal töltött mikrogömböket használ, hogy megakadályozzák a tumor vérellátását és éhezik.
A rák kezelésének lehetősége mellett a sugárterápia is palliatív; vagyis elősegítheti a fájdalom és a szenvedést a fejlett rákban szenvedő betegeknél. A súlyos fájdalommal, a bántalmakkal járó betegségben vagy a daganatos betegségben szenvedő betegeknél a palliatív sugárzás révén javul az életminőség.


















Kommentek
Kommenteléshez kérlek, jelentkezz be: