Mi az endometriális rák?
Az endometriális rák akkor kezdődik, amikor a méh belső bélésében lévő sejtek (endometrium) elkezdenek növekedni. A test szinte bármelyik részében lévő sejtek rákosodhatnak, és terjedhetnek a test más területeire. Ha többet szeretne tudni arról, hogy a rákok hogyan kezdenek elterjedni és terjedni, nézze meg, mi a rák?
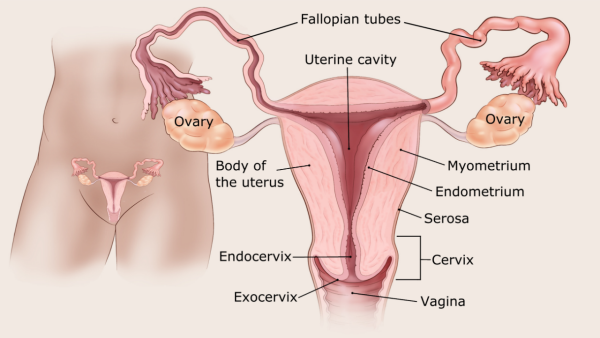
A méhről és az endometriumról
A méh üreges szerv, amely általában a közepes méretű körte méretéről és alakjáról szól. A méh az, ahol a magzat nő és fejlődik, amikor egy nő terhes. A méhnek két fő része van (lásd az alábbi ábrát):
- A méhnyak a méh alsó vége, amely a hüvelybe nyúlik.
- A méh felső részét az test vagy a test. (test a latin szó a test számára.)
Bár a cervix technikailag a méh része, amikor az emberek a méh rákról beszélnek, általában a testet értik, nem a méhnyakot.
A méh testének két fő rétege van. A belső réteg vagy bélés az úgynevezett endometrium. A külső réteg izom ismert méhizomzat. Ez a sűrű izomréteg szükséges ahhoz, hogy a születés ideje alatt kiszorítsa a babát. A méh külső részének bevonata a savóshártyát.
A nők menstruációs ciklusa alatt a hormonok megváltoztatják az endometriumot. A ciklus korai szakaszában, mielőtt a petefészkek felszabadítanak egy tojást (ovuláció), a petefészek termelnek hormonokat ösztrogének. Az ösztrogén az endometriumot sűríti, hogy terhességet biztosítson, ha terhesség következik be. Ha nincs terhesség, az ösztrogént alacsonyabb mennyiségekben és több hormonként állítják elő progeszteron az ovuláció után történik. Ez felkészíti a bélés legbelső rétegét. A ciklus végéig az endometrium bélés a méhből kiszabadul és a menstruációs áramlás (időszak) lesz. Ez a ciklus megismétlődik, amíg a nő nem válik menopauza (életváltozás).
A méh és a méhnyálkahártya típusai
A méh két fő típusa a következők:
- Méhtartalmú szarkómák, amelyek az izomrétegben (myometrium) vagy a méh alátámasztó kötőszövetében kezdődnek. Ezek közé tartoznak a méh leiomyoszarcomák és az endometrium stromalis szarkóma. Ezek a rákok nem tartoznak ide, de részletesen tárgyalja őket Uterine Sarcoma.
- Endometriális karcinómák, amelyek a méh belső bélésének sejtjeiben (endometrium) kezdődnek. A méh szinte minden rákja ilyen. Ezek a rákok a további információk középpontjában állnak.
Az endometriális karcinómák különböző típusokra bonthatók, a sejtek mikroszkóp alatt (hisztológiai típusok) való megfigyelésén alapulva. Ezek tartalmazzák:
- Adenocarcinoma, (a legtöbb endometrium daganat adenocarcinoma)
- Karcinoszarkóma (részletesebben lásd lent)
- Squamous cell carcinoma
- Nem differenciált karcinóma
- Kissejtes karcinóma
- Átmeneti karcinóma
Az adenokarcinóma leggyakoribb típusa endometrioid rák. Az endometrioid rákok olyan mirigyekből álló sejtekből állnak, amelyek hasonlítanak a normális méh béléshez (endometrium). Ezeknek a rákoknak egy része lapos sejtek (a laphámsejtek laposak, vékony sejtek találhatók a méhnyak külső felszínén), valamint mirigyejtő sejtek.
Az endometrioid rákok számos variánsa (vagy altípus) léteznek, beleértve:
- Adenocarcinoma, (lapos differenciálódással)
- Adenoacanthoma
- Adenosquamous (vagy vegyes sejt)
- Titkos karcinóma
- Csontos karcinóma
- Villoglanduláris adenokarcinóma
Tiszta sejtes karcinóma, mucinos adenokarcinóma, és papilláris szeros adenokarcinóma az endometriális adenokarcinómák kevésbé gyakori típusai. Ezek a típusok inkább agresszívabbak, mint a legtöbb endometrium-rák. Gyakran nőnek gyorsan és gyakran terjednek a méhen kívül a diagnózis idején.
Endometriális karcinómák osztályozása
A fokozat a méhnyálkahártya-rák azon alapul, hogy mennyi a rák olyan mirigyeket képez, amelyek hasonlítanak a normál, egészséges endometriumban található betegségekhez.
Ban ben alacsonyabb fokú rákos megbetegedések (1. és 2. fokozat), több rákos szövet formálja a mirigyeket.
Ban ben magasabb fokú rákos megbetegedések (3. fokozat), a rákos sejtek többsége rendszertelen vagy disorganizált módon van elrendezve, és nem alkot mirigyeket.
- 1. osztály tumorok a rákos szövetképző mirigyek 95% -át vagy annál többet tartalmaznak.
- 2. fokozat a tumorok a rákos szövetképző mirigyek 50-94% -a között vannak.
- 3. fokozat a daganatok a rákos szövetképző mirigyek kevesebb mint felét tartalmazzák. A 3-as fokozatú rákok általában agresszívek és gyengébbek, mint az alacsonyabb rákos megbetegedések.
Az 1. és 2. osztályba tartozó endometrioid rákok az 1. típusú endometrium daganatok. Az 1-es típusú rák általában nem nagyon agresszív, és nem terjed gyorsan más szövetekre. Úgy tűnik, hogy az 1. típusú endometrium daganatok túlzott ösztrogén okozta. Ezek néha az atipikus hiperpláziából, a sejtek abnormális túlnövekedéséből származnak az endometriumban (lásd a kockázati tényezőket).
Kisméretű endometrium daganatok vannak 2. típusú endometriumrákot . A 2-es típusú rákok nagyobb valószínűséggel nőnek és terjednek a méhen kívül, rosszabb kilátásokkal rendelkeznek (mint az 1-es típusú rákos megbetegedések). Az orvosok hajlamosak agresszíven kezelni ezeket a rákokat. Úgy tűnik, nem okoz túl sok ösztrogént. A 2. típusú daganatos megbetegedések közé tartoznak az összes olyan endometriális karcinóma, amely nem tartozik az 1-es típusba, például papilláris szeros karcinóma, tiszta sejtes karcinóma, differenciálódott karcinóma és 3. fokú endometrioid karcinóma. Ezek a rákok nem úgy néznek ki, mint a normális méhnyálkahártya, és így nevezik rosszul differenciált vagy magas fok.
Méhtest karcinoszarkóma (CS) az endometriumban kezdődik, és mind az endometriális karcinóma, mind a szarkóma jellemzőivel rendelkezik. A múltban a CS-t a méhszarkóma típusának tekintették, de az orvosok most úgy vélik, hogy a CS egy rendellenes karcinóma, és így már nem hasonlít a sejtekhez (rosszul differenciált).
Az uterus CS típusú endometrium karcinóma. CS daganatok is ismertek rosszindulatú kevert mezodermális daganatok vagy rosszindulatú kevert mullerianusok tumorok (MMMTs). A méhrák körülbelül 4% -át teszik ki.
Méhnyakrák
Azok a rákok, amelyek a méhnyakon kezdődnek, majd terjednek a méh testére, különböznek a méh testében kezdődő rákos megbetegedéstől; azokat ismertetik Méhnyakrák.
Endometriális karcinóma
Gyakorlati alapismeretek
Az endometriális rák (más néven corpus méh rák vagy corpus rák) a fejlődő világban a leggyakoribb női nemi szervi rák, az endometrium adenocarcinoma a leggyakoribb. [1] Az Egyesült Államokban a nők becsült 2,8% -át diagnosztizálják a malignitásuk egy bizonyos ponton az életük során. [2]
jelek és tünetek
Az endometriális rákban szenvedő nők kb. 75% -a posztmenopauzális. Így a leggyakoribb tünet a posztmenopauzális vérzés.
Az endometriális rákok 25% -ánál a perimenopauzális vagy premenopauzás betegeknél a rákot sugalló tünetek finomabbak lehetnek. A normális menstruációs vérzés ezen időszak alatt könnyebbé és könnyebbé válik, tovább és tovább szétesik. A súlyos, gyakori menstruációs időszakokat vagy az intermenstruációs vérzést ki kell értékelni.
További részletekért lásd a klinikai bemutatót.
A gyanított endometrium-karcinómában szenvedő nő vizsgálata a következőket tartalmazza:
Miután az endometriális rák diagnózisát elvégezték, rutin elővizsgálatot végeznek az operabilitás értékelésére, beleértve a megfelelő vérvizsgálatokat, az elektrokardiográfiát és a mellkasröntgezést.
Néhány kutató úgy véli, hogy az endometriális csík értékelésére szolgáló hüvelyi ultrahangvizsgálat az első diagnosztikai eljárás, mivel a hüvelyi ultrahangvizsgálat kevésbé invazív, mint az endometriális biopszia. Azonban az endometriális csík használatának korlátozása a további diagnosztikai tesztek kritériumaként (pl. Endometrium biopszia) több feltétel (pl. Endometrium polip, elhízás, cukorbetegség, tamoxifen beadása) esetén is hamis adatok.
A hidrosztrasonográfiát annak biztosítására használják, hogy ez nem hamis pozitív eredmény, ha az endometrium vastagodik.
Az endometrium állapotának meghatározására a következő eljárásokat alkalmazzuk:
Endometriális rák diagnosztikai hiszteroszkópia. Videó jóvoltából Tarek Bardawil, MD.
További részleteket a Workup című részben talál.
vezetés
Az endometriális rák kezelése a betegség stádiumától és a páciens sebészeti jelöltségétől függ. Általában ajánlott a műtét.
Az endometriális rák kezelésére alkalmazott operatív eljárások a következők:
A kemoterápiás gyógyszerek, mint például a ciszplatin endometriális karcinóma kezelésében alkalmazhatók.
További részleteket a Kezelés és gyógyszeres kezelés című témakörben talál.
Háttér
A corpus rák a leggyakrabban előforduló női nemi szervi rák. A fejlett országokban az endometrium adenokarcinoma a leggyakoribb nőgyógyászati rák; azonban a fejlődő országokban sokkal kevésbé gyakori, mint a méhnyakrák.
2015-ben várhatóan körülbelül 54,870 új méhnyálkahártya-megbetegedésről számoltak be (az összes új amerikai rákos eset közül 3,3%); ezeknek a nőknek kb. 10 170 elhalál a betegségből (az összes rákos halálozás 1,7% -a). [2] A 20. század elején a méhnyak rákja több amerikai nővel meggyilkolt, mint bármely más rák, de az elkövetkező évtizedekben a méhnyálkahártya-rosszindulatú megbetegedések incidenciája csekély mértékben csökkent. Ezt a csökkenést a Papanicolaou-teszteléssel (Pap feltűnés) végzett szűrés hatására jóváhagyták. A kevésbé fejlett országokban a méhnyakrák szűrését igen ritkán végzik, ezért a méhnyak rákja igen gyakori.
A beteggondozási erőforrásokért lásd a Női Egészségközpontot és a Rákközpontot, valamint a hüvelyi vérzést és a méhnyakrákot.
Több epidemiológiai kockázati tényezőt azonosítottak az endometrium adenokarcinóma esetén.
Endogén tényezők
Az elhízás növeli az endometriális rák kialakulásának kockázatát, és egyes adatok arra utalnak, hogy 2-3-szoros kockázatnövekedés következik be, ha az egyén súlya meghaladja az 50 fontot, mint az ideális testsúlyt.
A nulliparity szintén növeli a 2- és 3-szoros kockázatot a paritáshoz képest.
Egy olyan személynek, aki késői menopauza volt (idősebb 52 év), úgy tűnik, hogy nagyobb a kockázata.
Ellenálló ösztrogén
Az ellenállóképes ösztrogén, vagy helyettesítő terápiaként vagy endogén módon termelt (pl. Granulosa sejt tumor, policisztás petefészek-betegség), növeli az endometriális rák kockázatát többször.
Az elhízásról tudjuk, hogy fokozza az endogén ösztrogént, mert úgy tűnik, hogy a zsír jelenléte felelős az androsztedion ösztrogénvegyületekké történő átalakításáért sokkal magasabb arányban, mint ha zsír nem jelenik meg.
Az anovuláció, amely másodlagos lehet az ellenállhatatlan ösztrogén hatására, szintén hozzájárul ehhez a helyzethez.
A legelterjedtebb daganatellenes szer a tamoxifen, és ezt a gyógyszert bizonyos tanulmányok javasolják, hogy fokozzák az endometrium adenokarcinóma előfordulását. Ezek az adatok olyan retrospektív analízisekből származtak, amelyekben az endometrium adenokarcinóma nem jelent végpontot több prospektív, randomizált vizsgálatban, amely értékeli a tamoxifen szerepét mellrákos betegeknél. [3]
A SEER adatbázist használó esetellenőrző vizsgálat azt jelzi, hogy ha a tényezőket összekeverik, az endometriális rák kockázata a tamoxifen kezelésben szenvedő betegeknél nem tűnik megemelkedettnek. [4] Ez a tanulmány nagyon megnyugtató, mivel a tamoxifen-kezelést igénylő nők számának növekedése nyilvánvalóvá válik, különösen, mivel a tamoxifen profilaktikus szerepe ajánlott a nagy kockázatú nők számára.
Kombinált orális fogamzásgátlók
A tamoxifennel szemben az adatok növekedése azt mutatja, hogy a kombinált orális fogamzásgátlók (OC-k) alkalmazása csökkenti az endometriális rák kialakulásának kockázatát.
Számos tanulmány rámutatott arra, hogy azok a nők, akik egy időben használják a testvérsejteket, 0,5-es viszonylagos kockázatot jelentenek az endometriális rák kialakulásának kockázatával szemben azoknál a nőknél, akik soha nem alkalmaztak OC-t. Ez a védelem olyan nőknél fordul elő, akik legalább 12 hónapig használtak OC-t, és a védelem az OC használatát követően legalább 10 évig folytatódik. A védelem a legszembetűnőbb nők számára kiemelkedő.
Dohányzás
A dohányzás nyilvánvalóan csökkenti az endometriális rák kialakulásának kockázatát. A dohányzás hatása a testtömeghez kapcsolódik. A nehezebb nők, akik dohányzik, a legnagyobb kockázatcsökkenés.
A dohányzó nők 1-2 évvel korábban ismertek menopauza alatt, mint a dohányzó nők.
Bár a dohányzás látszólag csökkenti a méhnyálkahártya korai szakaszainak kialakulásának kockázatát, ez az előny erősen meghaladja a tüdőrák és a dohányzás egyéb jelentős egészségügyi problémáinak kockázatát.
Kapcsolódó orvosi körülmények
Egyes összefüggő egészségügyi állapotok azt találták, hogy növelik az endometriális rák előfordulási gyakoriságát. A méh, a vastagbél és a petefészek-rák gyakran megfigyelhető az endometrium-rákban szenvedő nőknél.
Az adatok arra utalnak, hogy az emlőrákban szenvedő nőknél az endometrium rák kialakulásának valószínűsége 2-3-szor nagyobb.
Az örökletes nem-polipózisú vastagbélrákban (HNPCC) szenvedő nőknél jelentősen megnövekedett az endometriális rák kialakulásának kockázata. A HNPCC-ben szenvedő nők a vastagbélrák valamennyi női esetének csak 2-10% -át teszik ki, de az összes méhnyálkahártya-rák kb. 5% -a fordul elő olyan nőknél, akiknél ez a kockázati tényező van. Ezek a nők életveszélyes kockázattal járnak az endometriális rák kialakulásának 22-50% -ánál, és a betegség fiatalabb korban (kb. 15 évvel korábban) fordul elő. A HNPCC-ben szenvedő nőknél a méhnyálkahártya-daganatok kialakulásának legnagyobb kockázata 40-60 év közötti életkor, amelynél az abszolút kockázat nagyobb mint 1% y-nál.
Jelenleg egyetlen adat sem utal arra, hogy a HNPCC-vel rendelkező nők éves szűrése a méhnyálkahártya-rákot elég korai szakaszban észleli, hogy javítsa a túlélést azokkal szemben, akiknél a tünetek megjelennek. Mindazonáltal, mivel ezek az egyének a méhnyálkahártya-daganatos megbetegedések magas kockázatával és a betegség potenciális életveszélyes természetének köszönhetően, a HNPCC-betegeket annyira tájékoztatni kell, és a szűrést minden bizonnyal javasolták. Az Amerikai Rákellenes Társaság irányelvei szerint a HNPCC-vel rendelkezõ nõknek 35 éves korig be kell nyújtaniuk az endometriális biopsziás szűrést.
Bjorge és munkatársai azt találták, hogy a metabolikus szindróma az endometriális karcinóma és halálos méhhártya-rák fokozott kockázatával jár. Különösen a magas testtömeg-indexű nőknél a társulás tűnik túlmutat az elhízás által okozott kockázaton. [5]
Családi történelem
Az endometriális rákos családban előforduló egyéneknek nagyobb a kockázata.
A fenotípus jellemzői
Egyszerre klasszikus fenotípusos jellemzőt feltételeztek egy olyan nő esetében, aki endometriális rák kialakulásához vezetne. Ez a fenotípus olyan betegeket is tartalmazott, akik sok esetben túlsúlyosak voltak, csomósak és anovulatívak. Újabban az endometriális rák két kórokozó típusának létezését értékelték.
Az első típus olyan nőknél fordul elő, akik a klasszikus kategóriába tartoznak. Ezek a nők elhízottak, hiperlipidémia, hyperestrogenizmus jelei, méhvérzés, meddőség és a menopauza késői megjelenése. A petefészek és az endometrium hyperplasia lehet. Ezek a betegek általában fehérek, elhízottak, rosszindulatúak és jól differenciált, felületesen invazív rákbetegek, amelyek érzékenyek a progeszteronra. Nagyon kedvező prognózisuk van, és az extrauterin betegség szokatlan ebben a betegcsoportban. Szerencsére az endometriális rákos nők többsége ebben a kategóriában van.
A második típus olyan nőknél fordul elő, akik a klasszikus bemutatóban egyik beteg állapotában sem szerepelnek. Ezek az egyének hajlamosak a rosszul differenciált daganatokra, a mély myometrium invázióra, a nyirokcsomók és más helyek magas fokú metasztázisára, a progesztinek csökkent érzékenységére és rossz prognózisra. Ezek a betegek általában vékonyak, sokoldalúak és afroamerikaiak.
Járványtan
Egyesült Államok statisztikája
A legfrissebb Felügyeleti, Epidemiológiai és Végeredmények (SEER) adatok 2008-2012-es esetekből származnak, amelyek 100 000 nő 100,1% -ánál összesen 25,1 esetet mutatnak. [2] A fehér nők előfordulási gyakorisága 25,8 eset / 100 000, szemben a 24 000 eset 100 000 beteg esetében. [2]
Verseny- és életkorral kapcsolatos demográfia
A halálozás magasabb a fekete nőknél (7,7 halálozás 100 000), mint a fehér nőknél (4,1 halálesés 100 000 betegen). Az ázsiai / csendes-óceáni szigetországban a legalacsonyabb halálozás (2,8% -os halálozás 100 000-enként) az összes faj között.
Az endometrium adenokarcinóma a reprodukciós és menopauzás évek során jelentkezik. A malignitással rendelkező nők átlagos életkora 70 év; a legtöbb beteg 65-74 éves. [2] A 40 évnél fiatalabb nők kb. 5% -a adenocarcinoma, és a nők 20-25% -át diagnosztizálják a menopauza előtt.
2015-ben várhatóan körülbelül 54,870 új méhnyálkahártya-megbetegedésről számoltak be (az összes új amerikai rákos eset közül 3,3%); ezeknek a nőknek kb. 10 170 elhalál a betegségből (az összes rákos halálozás 1,7% -a). [2] A 2010-2012-es adatok alapján a nők becsült 2,8% -át endometriális rák diagnosztizálják életük során. [2]
Az endometriális rákra számos prognosztikai tényező létezik. Ezek a prognosztikai tényezők általában sebészi patológiás leletekkel kapcsolatosak. Mint minden rákban, a legfontosabb prognosztikai tényező a betegség színvonala. Nyilvánvaló, hogy a műtéti eljárás segít meghatározni a színpadot. Az alábbiakban felsoroljuk olyan prognosztikai tényezőket, amelyek kifejezetten a betegség színpadára vonatkozhatnak, és ezáltal befolyásolhatják a teljes túlélést.
Prognosztikai tényezők – hisztopatológiai altípusok
A legtöbb endometrium carcinoma endometrioid adenokarcinoma. Az adenoacantómák (jóindulatú lemezes komponensek) és adenszkvangos karcinóma (rosszindulatú lemezes komponensek) a következő legnagyobb kategóriát alkotják.
A tiszta sejt- és papilláris ürgeadenokarcinómák az endometrium-daganatok körülbelül 10% -át teszik ki, és gyenge hisztopatológiai altípusok. Ezek az utóbbi altípusok hajlamosak mélyen invazív myometrialis részvételre, és hajlamosak az extrauterin terjedésére, annak ellenére, hogy a myometrium felületesen érintett lehet.
Korábban az adenosquamous karcinómában szenvedő betegnek rossz szándékú prognosztikai jellegűnek bizonyult a malignus lemezes komponens miatt.
A kortárs adatok arra utalnak, hogy függetlenül attól, hogy jelen van-e egy laphámos komponens (akár jóindulatú, akár rosszindulatú), a prognózis közvetlenül az adeno komponens fokozatához kapcsolódik, és nem annak a ténynek, hogy jelen van egy lapos rosszindulatú daganat. Ha rosszindulatú, lapos komponens van jelen, nagyobb a tendencia a rosszul differenciált adeno komponens jelenlétére.
Újabban jelentős bizonyítékok arra utalnak, hogy a karcinoszarkómák (CS) nem igazi szarkóma, mivel úgy tűnik, hogy epitéliumokból származnak. Ennek eredményeképpen a CS-k az endometriális daganatok részhalmazaként tekintendők (2. típus). [6]
Hisztológiai differenciálás
Az endometriális rák szövettani differenciálódásának mértéke már régóta elfogadott a prognózis érzékeny mutatójaként. A jól differenciált adenokarcinómákban szenvedő betegek általában az endometrium vagy a felületi myometrium bevonásával járnak, és az extrauterin betegség szokatlan.
Ha azonban rosszul differenciált elváltozás van jelen, ezek a rákok sokkal agresszívebbek, jelentős myometrális invázióval járnak, és gyakran extrauterin metastasisban vagy pozitív peritonealis citológiával, retroperitoneális elterjedéssel vagy a kismedencei és / vagy para-aorta nyirokcsomók.
Mivel a papilláris és a tiszta sejt karcinómák viszonylag gyenge prognózissal társulnak, ezek az altípusok általában nem osztályozottak, de ugyanabba a kategóriába tartoznak, mint a rosszul differenciált rák.
A myometrium invázió mértéke továbbra is a tumor virulencia következetes jelzése. Ahogy a myometrium invázió mélysége nő, az extrauterin betegség esélye nagyobb.
Mint fentebb említettük, az invázió minősége és mélysége, általánosságban, összefüggésben áll egymással. Ahogy a tumor fokozata növekszik, a myometrium invázió mélységében általában növekedés tapasztalható; kivétel azonban abban áll, hogy az 1. fokozatú elváltozás mély mezo-rium invázióval járhat, és a 3. fokú elváltozás az endometriumra korlátozható.
Amikor az invázió minősége és mélysége külön-külön értékelhető, az invázió mélysége fontosabb prognosztikai tényezőnek tűnik, mint a daganat minősége.
A peritoneum citológiai értékelése fontos prognosztikai tényezőnek tűnik. Bár az egyetemi egyetértés nem született a citológiai értékelés eredményeinek jelentőségéről, az irodalomban szereplő adatok túlnyomó többsége azt sugallja, hogy független prognosztikai faktort jelentenek.
A citológiai értékelés eredményei szintén hasonlítanak más prognosztikai tényezőkhöz, mint például a myometrális invázió mélysége és a nyirokcsomó metasztázis.
A FIGO állomásrendszer kimondja, hogy a pozitív citológiát külön kell jelenteni a szakasz változtatása nélkül. Ha a feltáró laparotómia idején nincs jelen ascitikus folyadék, akkor a medence és az alsó hasvíz sóoldatot végeznek, és a mintát citológiai értékelésnek vetik alá.
Nyirokcsomó metasztázis
Számos beteg, akikről úgy gondolták, hogy klinikai I. stádiumú endometriális rákban, valójában nyirokcsomó metasztázis volt, amikor histopatológiai értékelést végeztek a nyirokcsomókban.
Ismét a prognosztikai tényezők közötti korreláció kimutatható. A rosszul differenciált rákos megbetegedésben szenvedő betegek, a papilláris szerózus és a tiszta sejt karcinómák, a mély myometrium invázió, a pozitív peritonealis citológia vagy az adnexális metasztázisok általában megnőnek a nyirokcsomó metasztázisának veszélyével.
A későbbi terápia az elsődleges műtét után a prognosztikai tényezők és a betegség terjedése függ. Ha a betegség a méhre korlátozódik, akkor a műtét megfelelő kezelésnek tűnik, kivéve a rosszul differenciált, mélyen invazív miometriummal rendelkező betegeket. Ezeknél a betegeknél az adatok arra utalnak, hogy a posztoperatív besugárzás valószínűleg előnyös lehet. A méhen kívüli betegségben a sugárterápia hatékony lehet; ezt azonban nem vizsgálták prospektív randomizált vizsgálatban. A legtöbb vizsgáló a besugárzás helyét sugározza, ha a nyirokcsomó metasztázis jelen van.
Az előrehaladott betegség (pl. Intraperitoneális betegség, peritoneális üregen kívüli betegség) esetén a szisztémás kemoterápia hasznos lehet. A vizsgálatok azt sugallják, hogy a karboplatin és a paklitaxel valószínűleg a szelektív kemoterápiát igénylő gyógyszerek.
Mint már korábban említettük, a staging a legfontosabb prognosztikai tényező. A legutóbbi éves jelentés (világméretű adatértékelés) FIGO műtéti beosztási besorolása alapján a betegség I., II., III. És IV. Stádiumában 87%, 76%, 63% és 37% -os 5 éves túlélési arányt figyeltek meg . Mivel léteznek szubstage-ek, amelyek figyelembe veszik a prognosztikai tényezőket, az I. szakaszban lévő szubstage-k közül négynek ténylegesen több, mint 90% -os 5 éves túlélési aránya van.
Egyre több adat áll rendelkezésre arra utal, hogy a myometriumban a lymphavascularis űrbejutás előrejelzi a fennálló betegséget és rossz prognózist. Kevésbé jól definiálható, hogy a rossz előrejelzés marad-e fenn, ha más prognosztikai tényezőket értékelnek.
Egy vizsgálatban az L1CAM sejt adhéziós molekula kifejeződését a korai stádiumú endometrium tumorokban expresszálták, és ez erős prediktora volt a daganatos megbetegedéseknek. Az L1CAM expressziójának 1021 paraffinba ágyazott példányaiban az I-es típusú endometriális rákban végzett retrospektív analízis során a kutatók azt találták, hogy a minták 17,7% -a pozitív volt az L1CAM-hoz képest, és hogy a medián követés 5,3 év alatt 51,4 % az L1CAM-pozitív esetek között, szemben az L1CAM-negatív esetek mindössze 2,9% -ával. A medián teljes túlélés 8,9 év volt az L1CAM-pozitív tumorokban szenvedő betegeknél, míg az L1CAM-negatív betegeknél a medián túlélést nem sikerült elérni. [7, 8]
A vizsgálatban az L1CAM-nak 0,74-es érzékenysége volt a megismétlődéshez és 0,77 a halálhoz, valamint a 0,91 és a 0,89-es sajátosságok voltak. Ezek az adatok arra engednek következtetni, hogy az L1CAM a legjobb prognosztikai faktor az eddigi I. kiadású I. típusú endometriális rákban.
szövődmények
A terápia során előforduló szövődmények közé tartoznak azok a szövődmények, amelyek általában magától a műtéti eljárásból várhatóak. Mivel lymphadenectomiát végeznek, fokozott vérzés alakulhat ki; azonban az eljárásból származó egyedi szövődmények általában nem fordulnak elő.
Postoperatív szövődmények várhatóak a beteg preoperatív klinikai állapotától függően. Amint korábban említettük (lásd az okokat), ezeknek a betegeknek többsége komorbiditással rendelkezik, mint például a magas vérnyomás, az elhízás, a cukorbetegség és a megnövekedett életkor.
Az egyik műtét utáni szövődmény, amely valamivel gyakoribb lehet, a thromboembolia, mivel ez megnövekszik azoknál a betegeknél, akik rákosak, elhízottak, és idősebbek. A jelenlegi gyakorlat szerint a legtöbb orvos valamilyen típusú profilaxist, például külső pneumatikus kompressziót vagy alacsony dózisú heparint használ.
Postmenopausális időszak
Mivel az endometriális rákban szenvedő nők kb. 75% -a postmenopauzás, a leggyakoribb tünet a posztmenopauzális vérzés.
A menopauza idején minden vérzést kivizsgálni, kivéve, ha a páciens ciklikus helyettesítő terápiában részesül, normálisan várt elvonási vérzéssel. A vérzés időtartama vagy mennyisége (vérzés nélkül) nem tesz különbséget.
Az a tény, hogy a posztmenopauzális vérzés csak körülbelül 20% -a okozza a rákot, méltányos, de nyilvánvalóan a diagnózist ki kell küszöbölni.
Perimenopauzális / premenopausális periódus
Mivel a méhnyálkahártya-rákok 25% -a olyan betegeknél, akik perimenopauzális vagy premenopauzális betegségben szenvednek, a rákot sugalló tünetek finomabbak lehetnek. Az a gondolat, hogy a perimenopauzális periódus alatt bármilyen vérzés valószínűleg a menopauza következménye, gyakori tévhit. Ezt a szabálytalan vérzést gyakran figyelmen kívül hagyja a beteg, sőt az egészségügyi szolgáltatók is. Ne felejtsük el, hogy a normál vérzési minta ez alatt az idő alatt könnyebbé és könnyebbé válik, és tovább és tovább szétesik. A gyakori menstruációs időszakokat vagy az intermenstruációs vérzést ki kell értékelni.
Fizikális vizsgálat
Mivel a vérzés általában az endometriumból következik be, a kismedencei vizsgálati eredmények teljesen normálisak lehetnek, a méhnyak és a normális méretű méh nem okoznak brutális bizonyítékot. Vegye figyelembe a következőket:
Imaging tanulmányok
Hüvelyi ultrahangvizsgálat
A múltban jelentették a hüvelyi ultrahangvizsgálat fokozott használatát az endometrium csík értékelésére.
Egyes kutatók úgy vélik, hogy ez lesz az első diagnosztikai eljárás, mivel a hüvelyi ultrahangvizsgálat kevésbé invazív, mint az endometriális biopszia.
Az endometriális csík használatának egyik nehézsége a további diagnosztikai tesztek kritériumaként (pl. Endometrium biopszia) az, hogy számos olyan körülmény jelenhet meg, amely hamis olvasatot eredményez az endometriális csíkon. Ez különösen igaz azoknál a betegeknél, akiknél endometriális polip lehet, elhízott vagy diabetikus, vagy akik tamoxifen-kezelés alatt állnak.
Hydroultrasonography
Ha sűrű endometrium van jelen, szerezzen be egy hidrosztrasonogramot, hogy ellenőrizze, hogy nincs-e hamis pozitív eredmény. Ezt úgy végezzük, hogy kis mennyiségű sóoldatot helyezünk az endometrium üregébe, majd megismételjük a hüvelyi ultrahangogramot.
Sok esetben, amikor az eredeti hüvelyi ultrahang-műszer jelentős mértékű méhnyálkahártya-vastagságot mutat, az ultrasonogram segíthet megkülönböztetni a patológiát az endometrium vastagságától.
További probléma, hogy az endometrium vastagsága jelentősen változhat a különböző faktoroktól függően. Az endometrium vastagsága attól függ, hogy a beteg elhízott vagy cukorbeteg, akár perimenopauzális, akár posztmenopauzás (és mennyi ideig), függetlenül attól, hogy hormonpótló terápiát alkalmazott-e, és hogy a terápia magában foglalja-e az ösztrogént vagy az ösztrogént és a progeszteront. Jelenleg nincs általánosan elfogadott iránymutatás a különböző klinikai forgatókönyvek mindegyikénél.
eljárások
Bár a frakcionális dilatáció és a curettage történetileg az endometriális rák megszüntetésének végleges diagnosztikai eljárása volt, a jelenlegi gyakorlatban az endometriális biopszia irodai eljárásként gyors, jól tolerált és nagyon érzékeny a diagnózis felállításához.
Ha az endometriális patológia nem szerepel a biopsziás mintákon, és a betegnek nincs további vérzése, további diagnosztikai vizsgálatokat nem kell elvégezni.
Ha a beteg továbbra is tüneti jellegű, akkor az endometrium üregének további értékelése szükséges.
Hysteroscopically irányított biopszia
Egy másik diagnosztikai eljárás, amelyet néhányan az endometrium állapotának meghatározására még pontosabb módszernek tartanak, egy hiszteroszkóposan irányított biopszia (lásd az alábbi videót); azonban a vizsgálatok azt mutatták, hogy ha az eredményeket összehasonlítjuk a hisztopatológiával, mindkét hamis pozitív és hamis negatív eredményt meg lehet jegyezni ezzel a technikával.
Endometriális rák diagnosztikai hiszteroszkópia. Videó jóvoltából Tarek Bardawil, MD.
Dilatáció és curettage
A formális dilatáció és curettage jelenlegi szerepe valószínűleg nagyon korlátozott, mert a diagnózist rendszerint az irodában lehet elvégezni.
Anesztézia alatt végzett vizsgálat
Ez szükség lehet olyan betegek esetében, akik vérzik, és nagyon sztenotikus cervicalis részük van. Anesztézia szükséges lehet az endometrium mintavételéhez szükséges megfelelő dilatáció elvégzéséhez.
Hisztológiai eredmények
A patológiai diagnózis nyilvánvalóan az endometriális üreg értékelésére vonatkozó kritérium. A gyanú magas indexét fenn kell tartani, ha mérlegelni kell az endometriális rák diagnózisát.
Az endometrioid adenokarcinóma a leggyakoribb kórszövettani altípus. A squamous komponens, vagy jóindulatú (adenocanthoma) vagy rosszindulatú (adenosquamous), nem befolyásolja a prognózist, de az adeno komponens minősége befolyásolja a prognózist. A papilláris súlyos és tiszta sejtkapsztípus rossz prognózist eredményez, de szerencsére nem gyakori az adenokarcinómához képest. A szekréciós karcinóma a legkevésbé gyakori rákos megbetegedés, és jó prognózissal jár.
Újabb adatok azt sugallják, hogy a korábban eredetileg szarkómának tekintett kevert malignus daganatok valójában hámszövet eredetűek, ezért itt kell szerepeltetni, mint primer szarkóma.
A Nemzetközi Nőgyógyászati és Szülészeti Szövetség (FIGO), a 2008-as corpus utéri karcinóma rendszere a következőképpen alakul [11]:
A corpus karcinóma eseteit a szövettani differenciálódás mértékének megfelelően kell osztályozni (vagy osztályozni). A hisztopatológia és a differenciálódás mértéke a következő:
* Vagy G1, G2 vagy G3.
** Az endocervicalis mirigy csak az I. stádiumnak tekinthető, és már nem a II.
A pozitív citológiát külön kell jelenteni a szakasz változtatása nélkül.
Megközelítés szempontjai
A méhnyálkahártya rák diagnózisának standard kezelése a műtétet jelenti, amelyet kemoterápiával követnek, sugárkezeléssel vagy anélkül. [1] В Az ismétlődő betegségek kialakulásában a másodlagos cytoredukció a progressziómentes (PFS) és általános (OS) túléléssel társult. [12] A hosszú távú operációs rendszert javító prognosztikai tényezők voltak a műtéti resektálás és a histotípus után fennmaradó betegség hiánya. [12]
A nyirokcsomó metasztázis fontos szempont a nagy kockázatú korai vagy fejlett endometriális rákos betegeknél. [13, 14] Az 523 francia sebész betegek adatainak értékelésében 12 éves periódus alatt Bendifallah és munkatársai kifejlesztettek egy prediktív modellt, amely azonosítja azokat a betegeket, akiknél magas a nyirokcsomó-metasztázisok kockázata. A hisztopatológiai jellemzők, tumor átmérő, mélység myometrium invázió, valamint a limfovaszkuláris tér érintettségének státusza. [13] Egy másik tanulmányban Fotopoulou és munkatársai arról számoltak be, hogy a pozitív nyirokcsomók anatómiai eloszlásának alapján, amikor nagymértékű korai vagy előrehaladott betegségben szenvedő betegeknél a lymphadenectomiát végzik, az eljárásnak kismedencei és para-aorta területeket kell tartalmaznia egészen a vesedektől, hogy pontosságot biztosítsanak az összes lehetséges pozitív csomópont értékelésében. [14]
Seagle és munkatársai két randomizált vizsgálatban vizsgálták a lymphadenectomia társulását a teljes túléléssel az I. stádiumú endometrioid és a csomó-negatív I-IIIB endometriális rákban szenvedő nők körében. Egy tanulmány szerint a kismedencei lymphadenectomia előrehaladása a megnövekedett túléléssel összefüggésbe hozható a lymphadenectomia nélkül (ötéves túlélés [95% CI], 91,4% [90,2% -ról 92,6% -ra] v 87,3% [85,9% és 88,8%]; HR, 0,71 [95% CI, 0,64-0,78]; P [15] Egy másik tanulmány arra a következtetésre jutott, hogy a megnövekedett nyirokcsomók száma 1% -14% -kal csökkent halálozási kockázattal jár minden további öt nyirokcsomó esetében, és 5-20% -kal nőtt az 5 éves túlélés a kórosan csomópont-negatív nők körében endometrioid és súlyos endometrium rák. [16]
Sebészeti ellátás
1988 óta a FIGO, akinek nőgyógyászati onkológiai bizottsága felelős a nőgyógyászati rák kialakulásáért, javasolta, hogy a corpus rák műtéttel kerüljön sor. Korábban klinikai értékelést használtunk a staging-ban, és több vizsgálatban megfigyelték a klinikai beavatkozás pontatlanságát a sebészeti patológiás eredményekhez képest. Ezért, miután a méhnyálkahártya-rák diagnózisát elvégezték, rutin előretöréses értékelést végeznek az operabilitás mérésére.
Vegye figyelembe a következőket:
Egy 2012-es vizsgálat megállapította, hogy az endometrium, a laparoszkópia és a laparotóma korai stádiumú elsődleges endometrioid adenokarcinóma a betegségtől mentes és az általános túléléshez hasonló gyakorisággal társul, és hogy a laparoszkópia csökkent operatív morbiditást és rövidebb kórházi tartózkodásokat eredményez. [18]
Iránymutatások összefoglalása
Útmutatók Közreműködő: Jori S Carter, MD, MSV egyetemi adjunktus, Nőgyógyászati Onkológiai Osztály, Szülészeti és Nőgyógyászati Osztály, Virginia Commonwealth Egyetem Orvostudományi Kar
Jelenleg egyetlen nagy szervezet sem javasolja a méhrák szűrését a tünetmentes nők számára. Az Országos Rákkutató Intézet (NCI) PDQ rákinformációs összefoglalója szerint a méhnyálkahártya rákszűrésére nincs bizonyíték arra, hogy a transzvaginalis ultrahangvizsgálat csökkenti az endometriális rákos megbetegedések mortalitását, és nincs elegendő bizonyíték arra, hogy az endometriális mintavétel (biopszia) csökkenti a mortalitást. A korai klinikai bemutatás és a korai észlelési arány (85%) miatt nem valószínű, hogy a szűrés sikeres hatást gyakorol a korábbi felismerésre és a túlélési arány növelésére. [19]
Az American Cancer Society (ACS) azt javasolja, hogy a menopauza idején minden nőt tudatában kell lenni az endometriális rák kockázatairól és tüneteiről, és erőteljesen ösztönözni kell minden váratlan vérzés vagy pikkelyzés jelentését az orvosuknak. [20]
Ezen túlmenően az NCI PDQ-rákra vonatkozó összefoglalója és az ACS egyetért abban, hogy az ösztrogénterápia vagy a tamoxifen terápia kapcsán bekövetkezett múltbeli méhnyálkahártya-megnövekedett kockázatok miatt nők esetében nincs arra utaló jel, hogy a rutinszűrés javítaná a korai észlelési vagy túlélési arányokat. Mint a nők átlagos kockázata, ezek a nők általában tüneteket mutatnak a korai stádiumban, amikor a prognózis jó. [19, 20]
Lynch-szindróma
A Lynch-szindrómás nők (örökletes nempolyposis kolorektális rák) a vastagbélrák kockázatának 80% -kal nagyobb kockázatát és a méhnyálkahártya-rák 60% -os fokozott kockázatát hordozzák. [21] В
A National Comprehensive Cancer Network (NCCN) iránymutatások az összes immunhiisztikus (IHC) vagy mikroszatellita instabilitást (MSI) tesztelik, függetlenül a családtörténelemtől, minden olyan személyen, akinél diagnosztizáltak kolorektális vagy endometriális rákot, hogy azonosítsák, mely betegeknek kell genetikai vizsgálatot végezni a Lynch-szindrómán. Ezenkívül Lynch-szindróma genetikai vizsgálatot kell végezni minden olyan nőre, akinél az endometriális rákkal diagnosztizálták az 50 éves kor előtt és a Lynch-szindrómás bárkinek családtagjait. [21] В
Az NCCN iránymutatásai a Lynch-szindrómás nők felügyeletére és kockázatcsökkentésére vonatkozó alábbi ajánlásokat tartalmazzák:
2014-ben az American College of Obstetricians és Nõgyógyászok (ACOG) és a Nõgyógyászati Onkológiai Társaság (SGO) közös iránymutatásokat tett közzé, amelyek azt javasolják, hogy az endometriális rákkal diagnosztizált összes nõt Lynch-szindrómára kell átvizsgálni. A genetikai tesztelés akkor előnyös, ha erőforrások állnak rendelkezésre, de a klinikai szűrés, amely magában foglalja a célzott családi előzményeket, elfogadható. Tünetmentes nőket is meg kell vizsgálni, akik első fokú rokonokkal rendelkeznek, akár 60 éves kor előtt akár endometriális vagy colorectalis rákos megbetegedéssel diagnosztizálva. [22]
Az ACOG / SGO ajánlásai a felügyeletre és a kockázatcsökkentésre vonatkozóan a következők:
Az Európai Orvosi Onkológiai Társaság, az Európai Nőgyógyászati Onkológiai Társaság és az Európai Radioterápiás és Onkológiai Társaság (ESMO / ESGO / ESTRO) által közösen kiadott konszenzus iránymutatások éves átvilágítást javasolnak a transzvaginális ultrahang és a biopszia alapján 35 éves kortól a hysterectomiáig minden Lynch-szindróma-mutációs vivő számára. Ezen túlmenően a Lynch-szindrómás nők kezelésében a következő ajánlások találhatók: [23]:
Megelőzés
Nemzeti Rákkutató Intézet
Az NCI PDQ-rákra vonatkozó összefoglalója megjegyzi, hogy az ösztrogén és a progeszteron tartalmú orális fogamzásgátlók legalább egy évig történő alkalmazása csökkenti az endometriális rák kialakulásának kockázatát. A csökkent kockázat arányos a használat időtartamával, és a haszon a megszakítás után legalább 15 évig fennmarad. Az orális fogamzásgátlók használata azonban a vérrögök, a stroke és a szívinfarktus fokozott kockázatával is jár együtt, különösen a dohányzó és 35 évesnél idősebb nők esetében. [19]
American Cancer Society
Az ACS a következő intézkedéseket ajánlja az endometriális rák kialakulásának kockázatának csökkentésére [20]:
A kolorektális rákban műtéten átesett és a termékenységet nem kívánó nőknek profilaxis-hysterectomia és / vagy oophorectomia
A National Comprehensive Cancer Network (NCCN) iránymutatásai a következő ajánlásokat tartalmazzák a gyanított endometriális rák kezdeti értékelésére [24]:
A Nőgyógyászati Onkológiai Társaság (SGO) és az Európai Orvosi Onkológiai Társaság (ESMO) iránymutatásai általánosságban hasonló ajánlásokat nyújtanak, de mindkettő a biopsziás hiszteroszkópiát és más diagnosztikai lehetőséget is magában foglalja. [25, 26] Nagy pontossága miatt az SGO a biopsziás hiszteroszkópiát tartja az arany standardnak a diagnózishoz. [25]
Az endometrium rákban gyakran alkalmazzák a következő két fő rendező rendszert:
A méhszarkómák korábban méhnyálkahártya-rákká alakultak. Ez azonban nem tükrözi a klinikai viselkedést, azonban egy új corpus szarkóma rendező rendszert fejlesztettek ki az egyéb lágyszövetszarkómákban alkalmazott kritériumok alapján. Lásd az alábbi táblázatot.
Asztal. Méhszarkóma (Leiomyosarcoma, Endometrium Stromal Sarcoma és Adenosarcoma)
A pozitív citológia negatív kockázati tényező. Bár a peritoneális citológiai eredmények nem befolyásolják a stagingot, a FIGO és az AJCC továbbra is azt ajánlja, hogy a peritoneális citológiát szerezzük be és jelentjük. [11, 27]
Kockázatértékelés
Az Európai Orvosi Onkológiai Társaság (ESMO) iránymutatásai a betegek kezelési csoportjaira rétegezik a betegség újbóli előfordulásának becsült kockázatára alapozott alábbiak szerint [26]:
A National Comprehensive Cancer Network irányelvek a következő kategóriákat használják az endometrioid rák kezelésére szolgáló csoportok meghatározására [24]:
Adjuváns terápia
A főbb iránymutatások egyetértenek abban, hogy a méhre korlátozódó I. stádiumú betegség elsődleges kezelése a műtét (teljes hisztektektómia és bilaterális salpingo-oophorectomia), valamint a teljes műtéti beavatkozás, beleértve a kismedencei mosást, a bilaterális medencét és a paraortális lymphadenectomiát. [24, 25, 26, 28, 23]
Az ajánlott sebészeti megközelítés az iránymutatások között változik. A National Comprehensive Cancer Network (NCCN) úgy véli, hogy a hysterectomia és az adnexectomiák laparotómia, vaginális úton vagy minimálisan invazív technikákkal, például laparoszkóppal vagy robotműtéten keresztül végezhetők. [24] A minimálisan invazív műtétet ajánlott az Európai Orvosi Onkológiai Társaságnak, az Európai Nőgyógyászati Onkológiai Társaságnak és az Európai Radioterápiás és Onkológiai Társaságnak (ESMO / ESGO / ESTRO). [23]
A Nőgyógyászati Onkológiai Társaság (SGO) a laparoszkópiát szokásos megközelítésként javasolja, és elfogadja a robot által támogatott technikákat. Mind az amerikai kollégium a szülészek és a nőgyógyászok (ACOG) és az SGO fenntartja a hüvelyi hysterectomia a kiválasztott nők számára, akik nagy a kockázata a műtéti morbiditás. [25, 28]
A nem invazív, 1. fokozatú daganatos betegeknél, akiknek meg kell őrizniük a termékenységet, az NCCN, az SGO és az ACOG mindegyike ajánlja a progesztin terápiát. A teljes sztreektektómia és a bilaterális salpingooophorectomia akkor jelentkezik, ha a gyermekvállalás befejeződik, vagy ha a rák még mindig jelen van 6-9 hónapos terápia után vagy a betegség progressziója következik be. A termékenységet megtakarító kezelésben részesülő nőket szorosan monitorozni kell az endometriális biopsziával 3 havonta. [24, 28, 29]
Az NCCN és az ESMO / ESGO / ESTRO irányelvek szerint az orvosi szempontból inoperábilis betegek esetében a sugárterápia vagy a hormonterápia lehet alternatív lehetőség. [24, 23] В
Amerikai Radiológiai Onkológiai Társaság
2014-ben az American Society of Radiation Oncology (ASTRO) a bizonyítékokon alapuló iránymutatásokat publikált a posztoperatív sugárterápia szerepére vonatkozóan. Az ajánlások a következőket tartalmazzák [30]:



Kommentek
Kommenteléshez kérlek, jelentkezz be: