Vese rák
A veserákot vesebetegségnek is nevezik. Ez a tíz leggyakoribb daganat egyike mind a férfiak, mind a nők számára.
A vese rákról
Vázrák áttekintése és a legfrissebb kulcsstatisztikák az Egyesült Államokban.
Okok, kockázati tényezők és megelőzés
Tudjon meg többet a vesekárosodás kockázati tényezőiről és arról, hogy mit tehet a kockázata csökkentésében.
Korai felismerés, diagnosztizálás és beavatkozás
Ismerje meg a vesekárosodás jeleit és tüneteit. Ismerje meg, hogyan tesztelik, diagnosztizálják és rendezik a vese rákot.
Vese-rák kezelés
Ha vesefunkcióval szembesül, segíthet megismerni a kezelési lehetőségeket és a lehetséges mellékhatásokat, és rámutat arra, hogy információt és szolgáltatásokat nyújtsanak a rákos út során.
Kezelés után
Tájékoztatást kaphat az életről mint rák túlélő, a következő lépésekről, és arról, hogy mit tehetsz, hogy segíts.
Könnyű olvasás
Ha Önnek van a rákbetegsége
Ha Ön vagy valaki, akit ismer, éppen diagnosztizáltak vese rákkal, ez a rövid, egyszerű útmutató segíthet.
Töltsön le ingyen PDF-fájlokat a vese rákra vonatkozó információinkról
A rák alapjai
Kezelési központok keresése
Online támogató közösségek
A legújabb rák hírek
Hope történetei
ACS kutatási hírek
Képzeljen el egy olyan világot, amely mentes a ráktól. Segítsen valósággá tenni.
Rákos információk
programok Szolgáltatások
ACS ALAPÍTÓK
További ACS oldalak
Rák információk, válaszok és remény. Minden nap minden percében elérhető.
Mi a tiszta sejtszarkóma?
A lágyszöveti sejtek szarkóma, amelyet nem szabad összetéveszteni a vese egyértelmű sejtszarkómájával, ritka a rák, amely elsősorban a 20-40 év közötti fiatal felnőtteket érinti. A szarkóma olyan rákos megbetegedés, amely a kötőszövetben, például csontban, izomban, zsírban és inakban keletkezik. Nyilvánvaló sejtszarkóma daganatok hajlamosak növekedni a végtagoknál, különösen a lábaknál és a kezeknél. Néha kialakulnak a gyomor-bélrendszerben, a bőr alsó rétegeihez és a törzs teljes helyén. A sejtes sarcoma enyhén gyakoribb a nőknél, mint a hímeknél.
A tiszta sejtszarkóma egy transzlokációhoz kapcsolódó szarkóma, ami azt jelenti, hogy egy genetikai mutáció meghatározza a betegséget. A kromoszómális transzlokációkban a két kromoszóma darabjait kicserélik, ami a gének abnormális fúzióját eredményezheti.
A sejtes szarkóma tumorok kétféleképpen osztályozhatók: helyileg vagy transzlokációs típus szerint. A tiszta sejtek szarkóma típusai a származási helyen alapulnak:
- tipikus tiszta sejtes kötegek és aponeuros szarkóma (lapos széles inak rétegei)
- gasztrointesztinális tiszta sejt szarkóma
- bőr-világos sejtes szarkóma (a bőrön)
Genetikai besorolás szerint a leggyakoribb típusok az EWSR1 / ATF1 vagy EWSR1 / CREB1 transzlokáció hordozója. Néha a tumorok nem észleltek EWSR1 transzlokációt.
Mi okozza a tiszta sejtszarkómot?
A tiszta sejtek szarkóma genetikai okát a meghatározó gén transzlokációjának tekintik. A transzlokáció nélküli sejtes szarkóma más, jelenleg ismeretlen genetikai mutációkkal is járhat, amelyek ugyanazt a hatást fejtik ki.
Milyen tünetei vannak a tiszta sejtek szarkómájának?
Először, a tiszta sejtek szarkóma nem okozhat tüneteket vagy fájdalmat. Néha a daganat mélységétől függően lassan növekvő csomóként észlelhető. A tumor befolyásolhatja az inak és szervek működését is, mivel nő és behatol a közeli szövetekbe. Idővel a fejlettebb rák tünetei kialakulhatnak, beleértve a fáradtságot, a fogyást és az étvágyat.
Hogyan diagnosztizálható a sejtes szarkóma?
A tumor felfedezése után egy vagy több biopsziát végeznek a diagnózis felállításához. A biopszia magában foglalja a tumor darabjának eltávolítását annak érdekében, hogy mikroszkóp alatt megvizsgálja.
A különböző típusú biopsziák között nyílt biopszia (műtéti behatolás a minta eltávolítására) vagy a magos tűs biopszia (a tenyészethez használt nagy tű) előnyben részesítendők. A sejtek eltávolítására alkalmas finom tű használata rák jelenlétét állapíthatja meg, de gyakran ezek a sejtek nem biztosítanak elegendő szöveget ahhoz, hogy a tiszta sejtek szarkóma jellemezhető legyen.
A kezdeti biopsziát gondosan terveznie kell tapasztalt sebész vagy radiológus. Ez a sebész lépéseket tesz annak biztosítására, hogy a biopsziás eljárás alatt zavaró tumorsejteket később teljesen eltávolítsák a műtét során a teljes tömeg eltávolítása érdekében.
Többféle biopszia létezik. Kezelőorvos először végezhet finom tűs aspirációt vagy magos tűs biopsziát. A finom tűs aspiráció különösen biztonságos és egyszerű eljárás egy nagyon vékony tűvel, de általában kis mennyiségű, diszaggregált sejteket kap, ami a legjobb a rák jelenlétének megerősítésére, de nem a típusára. A magos tűs biopszia egy vastagabb tűt (gyakran a radiológiai vizsgálat segítségével) alkalmaz, hogy megvizsgálja az ép daganatszövetet, és lehetővé teszi a patológusok számára, hogy a legtöbb esetben végleges diagnózist hozzanak létre. A biopszia leginkább tájékoztató jellegű sebészi biopszia, amely lehet excisional vagy incisional. A teljes daganat eltávolítása során kivételes biopsziát veszünk, míg a behatolásos biopszia sebészeti úton eltávolítja a viszonylag nagy darabszámú daganatot, amely az esetek túlnyomó többségében magabiztos végső diagnózist tesz lehetővé.
Mikroszkóp segítségével a patológusok megfigyelhetik a tumorminták sejtes megjelenését. A patológusok képesek azonosítani a daganat típusát a mikroszkópos megfigyelés és számos speciális molekuláris technika segítségével. Azonban a tiszta sejtek szarkóma szoros hasonlósága a rosszindulatú melanómához még mindig megnehezíti a helyes diagnosztizálást anélkül, hogy további genetikai vizsgálatokat igényelne, amelyek képesek azonosítani a specifikus betegségekre utaló mutációkat. A tiszta sejtek szarkóma jó példa egy olyan mutációra, amely genetikai tesztet talál: az EWSR1 / ATF1 vagy EWSR1 / CREB1 transzlokáció.
Általában többszörös leképezés készül a páciens gondozásában, hogy nyomon kövesse a tumor növekedésében és a metasztázisokban bekövetkező változásokat. A tiszta sejtszarkóma daganatokat gyakran MRI-k képezik. Az MRI kontrasztot különböztet meg a kémiai kötések különböző típusaihoz képest, amelyek mágnesességet alkalmaznak, lényegében kontrasztos szöveteket tartalmaznak magas víztartalmú, nagy zsírtartalmú szövetekből, hogy szürkeárnyalatos képet alkossanak. A tiszta sejtszarkóma tumorokat tovább lehet jellemezni egy beinjektált MRI kontrasztanyag alkalmazásával (amely néha szájon át alkalmazható a gasztrointesztinális daganatok esetében). A mellkas röntgensugaras vagy CT-vizsgálatokat a tüdőben előforduló metasztázisok ellenőrzésére használják. A PET-vizsgálat az enyhe radioaktív cukor intravénás beadását használja a metasztázisok szinte bárhová történő kimutatására.
A szarkóma stádiumát a minta kombinációja határozza meg (milyen mértékben agresszív a sejtek a mikroszkóp alatt), a tumor méretét, helyét és metasztatikus terjedését, és az onkológusok használják egy kezelési terv kidolgozását.
Hogyan kezeljük a sejtes sarcomát?
A fő daganat helyi kontrollját a sebészet (széles helyi kivágás). Mivel a tiszta sejtes szarkóma általában invazív, a sebész eltávolítja a daganatot körülvevő normál szövet “margin” -ját, hogy a lehető legtöbb rákot eltávolítsa.
Sugárkezelés, miközben önmagában nem gyógyító, gyakran használják a sebészeti területen, hogy megöljenek a tumor körül kerülő mikroszkopikus tumorsejteket, és ezáltal csökkentik a helyi kiújulás esélyét. A műtét előtt a sugárkezelés zsugorodik, és kisebb sebészeti beavatkozást tesz lehetővé. 1
A mai szabvány kemoterápiás a gyorsan növekvő rákos sejteket megöli a normál sejteknél. Ritkán bizonyították, hogy javítja a túlélést tiszta sejtes szarkóma betegekben, valószínűleg a viszonylag lassú növekedés miatt. Két FDA által jóváhagyott kemoterápiát alkalmaznak a lágyrész szarkóma kezelésében az ifoszfamid és a doxorubicin.
A legígéretesebb kísérleti stratégiák a tiszta sejtek szarkóma kezelésére célzott terápiák, amelyek arra szolgálnak, hogy a rákos sejtek sajátosságait célozzák. A célzott terápia egyik típusa egy receptor tirozin-kináz inhibitor, amely blokkolja a rákos sejtek növekedését elősegítő ráksejtekben a túl aktív jelátviteli molekulákat. A CREATE nevű klinikai vizsgálat a receptor tirozin-kináz-inhibitor crizotinib-t teszteli a lokálisan előrehaladott és metasztatikus tiszta sejtes szarkóma esetén. A célzott terápia másik típusa, epigenetikus terápia, olyan enzimeket céloz meg, amelyek kémiailag módosítják a DNS-t. Ezek közül különösen a hiszton-deacetiláz inhibitorokat tanulmányozzák világos sejtes szarkóma esetén.
Tiszta sejtes szarkóma betegek prognózisa
A prognózis statisztikái a tiszta sejtek szarkóma betegcsoportjainak vizsgálatán alapulnak. Ezek a statisztikák nem képesek megjósolni egy beteg jövőjét, de hasznosak lehetnek a páciens legmegfelelőbb kezeléséhez és nyomon követéséhez.
A tiszta sejtek szarkóma prognózisa őrzött, főként azért, mert a betegséget nehéz korán elkapni, és a kezdeti diagnózis után nagyon hajlamos a visszaesésre és elterjedésre. Az öt, tíz és húszéves betegség-specifikus túlélési arányt 67%, 33% és 10% között jelentették. A betegek prognózisának legnagyobb meghatározója a daganat mértéke a műtét előtt: az 5 cm-nél kisebb átmérőjű daganatok sokkal jobb hosszú távú túléléssel járnak, mint a nagyobb daganatok. 3
A tiszta sejtek szarkóma ritkasága miatt kihívást jelent a statisztikailag jelentős klinikai vizsgálatok elvégzése a létező vagy új gyógyszerek előnyeinek bizonyítására. Bár a betegség jelenleg nehezen kezelhető, a kísérleti terápiák esettanulmányokban ígéretet tettek, és a lágyszövet szarkóma klinikai vizsgálatai során aktív vizsgálatot végeztek.
Utolsó felülvizsgálat és orvosi felülvizsgálat: 10/2012
Által Garrett Barry
és Torsten O. Nielsen, PhD
1. O’Sullivan B, Davis AM, Turcotte R, Bell R, Catton C, Chabot P, Wunder J. et al. 2002. A műtét utáni operatív radioterápia a végtagok lágyszöveti sarcomájában: randomizált vizsgálat. Lancet 359 (9325): 2235-41.
2. Speleman R és Sciot F. 2002. A lágyszövet sejtjeinek világos sejtje. Az Egészségügyi Világszervezetben a daganatok osztályozása A puha szövet és csont tumorok patológiája és genetikája, szerk. C Fletcher, K Unni, F Mertens, 211-212. Lyon: IARC Press.
3. Sara AS, Evans HL és Benjamin RS. A puha részek rosszindulatú melanoma (Clear Cell Sarcoma): 17 eset vizsgálata, kiemelve a prognosztikai tényezőket. Cancer 65, 367-374.
Copyright © 2012 Liddy Shriver Szarkóma Kezdeményezés.
A puha szövet szisztémás sejtes szarkóma: részletes áttekintés
egy ESUN Cikk, Garrett Barry és Torsten O. Nielsen, Ph.D.
Kínai, francia, portugál és spanyol nyelven is kapható
Bevezetés
A puha részek rosszindulatú melanóma néven ismert lágyszöveti sejtek szarkóma rossz prognózisú daganat, amely elsősorban a húsz-negyven év közötti fiatal felnőtteket érinti. 1 Ez a tumor különbözik a véletlenszerűen megnevezett, tiszta sejtes sarcomától, egy ritka gyermekgyógyászati vese tumorból, amely nagymértékben változó hisztológiai mintázatokkal és a csontáttétek előítéletével szemben. 2 Az egyszerűség kedvéért a “tiszta sejtszarkóma” kifejezést a felülvizsgálat során fel kell használni a lágyszöveti rákra utalva.
A világos sejtszarkómát 1965-ben Franz Enzinger ismerte fel korábban nem ismert malignus szarkóma, amely az inak és az aponeurosisok által társult, morfológiailag különbözik az ilyen szövetek egyéb rosszindulatú daganataitól, mint például a fibrosarkó és a szinoviális szarkóma. Azóta számos technológiai fejlődés – köztük a citogenetikai karyotipizálás, a polimeráz láncreakció (PCR), a fluoreszcencia in situ a hibridizáció és a szöveti mikroarray-ok nem csak a jobb diagnosztikai eszközöket eredményezték, hanem a tiszta sejtek szarkóma molekuláris biológiájának és genetikájának megértését is. 4.5 Mindazonáltal sok kérdés merül fel azzal kapcsolatban, hogy a tiszta sejtszarkómákban jelen lévő genetikai mutációk miért okoznak olyan agresszív betegséget, amely nagyon ellenáll az aktuális kemoterápiáknak. 6
A kromoszómális transzlokáció a tiszta sejtszarkómában
A transzlokációhoz társuló szarkómák, mint például a tiszta sejtes szarkóma, az Ewing-családba tartozó daganatok és a dezmoplasztikus kis kerek sejtdaganatok nem homológ kromoszómális transzlokációval rendelkeznek, és két különböző kromoszóma egymásba osztja egymást, amelyek a betegség progressziójában alapvetőek. A legtöbb esetben a kromoszómális transzlokációk ezeken a daganatokban kiméra mester transzkripciós faktorokat generálnak úgy, hogy egy transzkripciós faktor DNS-kötő domént egy másik transzkripciós faktor szabályozó doménjébe fuzznek, ami az eredeti célgének szabályozatlan expressziójához vezet. Ezek az események alapvetőnek tekinthetők az onkogén vezető mutációknak: bár ezek a szarkóma sejtek gyakran visznek viszonylag kevés genetikai mutációt, a mester szabályozó onkogének bevonásával végzett transzlokációk egyidejűleg szabályozzák a rák előrehaladásához vezető downstream onkogéneket. Ezt legjobban jellemeztük a szinoviális sarcomával a szinoviális sarcoma egérmodell találmányával, ahol az SS18 / SSX fúziós onkoprotein feltételes expressziója, mint az egyetlen éretlen egér myoblastokban expresszált humán fehérje, olyan tumorok kialakulásához vezet, amelyek ugyanolyan hisztológiájúak , a humán szinoviális szarkómokra jellemző proteint és gén expressziós profilváltozásokat. Hasonlóképpen, az EWSR1 / FLI1 fúziós onkoprotein kifejeződése után különböző emberi mesenchymalis sejtvonalak rosszindulatú transzformációnak vannak kitéve, következetesen Ewing-család-daganatokban. 8,9
A pleomorf szarkóma és a legtöbb karcinóma gyakran bonyolult mutációs profiljaival ellentétben a transzlokációhoz kapcsolódó szarkómák genetikai változásokkal rendelkeznek, amelyek legalábbis elméletileg ideálisak a célzott terápiák számára. A tiszta sejtszarkóma egy in-frame t (12; 22) (q13; q12) transzlokációval rendelkezik, amely egy EWSR1 / ATF1 fúziós onkoproteint termel. Ha ennek az onkoproteinnek a hatása megfordítható egy célzott terápiával, a tumor növekedésének várhatóan meg kell állnia, nagymértékben javítania kell a prognózist, vagy esetleg meg is kell gyógyítania a betegeket ezzel a betegséggel.
Kromoszómális transzlokációk akkor fordul elő, ha két kromoszóma részei megszakadnak, és a különböző szekvenciák összeolvadnak egymással. Ezzel ellentétben, a szexuális reprodukció során a kromoszómális keresztezés a kromoszómák azonos (homológ) régiókon belüli cseréjével jár. A kromoszómális transzlokációk valójában viszonylag gyakori események lehetnek, de ritkán fordulnak elő a gének közepén, hogy különböző kromoszómákból származó fúziós fehérje szekvenciákat kódoló transzkriptumokat állítsanak elő, mint a tiszta sejtes szarkóma esetében. Különösen problematikus, ha ezek a kóros fúziók “mester” transzkripciós faktorokat tartalmaznak, amelyek szabályozzák a celluláris kontroll számos útját, és állandóan új szabályozó tényezőkhöz kapcsolódnak.
mesenchyma a mezoderm (“középszövet”) eredetű differenciálatlan kötőszövet egy formája az embriogenezis során. A mezzimális sejtek különbözõ szövetekben, például izomban, csontban és inakban különböztethetõk meg. Definíció szerint a szarkóma a mesoderm-eredetű szövetek rákos megbetegedése, és a mezenchymalis sejtek onkogén transzformációját feltételezik. Számos kísérlet során próbálták mesterségesen reprodukálni az onkogén transzformációt mezenhimális sejtekben ismert szarkóma-mutációk, például transzlokációk bejuttatásával és megfigyelve, hogy a sejtek olyanokká válnak-e, mint a várható szarkóma. Az ilyen kísérletek eredményesek voltak az Ewing családba tartozó tumorok, a csont és a lágyszövetek csoportjában előforduló szarkóma csoportja, amelyet általában egy EWSR1 / FLI1 fúziós onkoprotein okozott.
A Clear Cell Sarcoma klinikai jellemzői
A legtöbb betegnél húsz és negyven év között jelenik meg a fájdalommentes tömeg a distalis végtagokban, különösen a lábaknál és a bokáknál, amelyeket az ín és az aponeuroszok rögzítettek. 1 Olyan helyekről is beszámoltak, mint a karok, a kezek és a törzs. 10 A tiszta sejtszarkóma elsősorban mélyen ülő és nagyon ritkán ered a bőr alsó részében vagy a bőr alsó részén. 1
A tiszta sejtes szarkóma lokálisan agresszív daganat, amely nagyfokú kiújulással és áttétellel (legfeljebb 50%). 1 Ötéves betegspecifikus túlélési arány 50-67% volt, de nem reprezentatív a hosszú távú túlélésre, mivel sok beteg tüdő- és csontmetasztázisokat vált ki több mint öt évvel az első reszekció után. 3 A tíz-húszéves betegség-specifikus túlélési arány jobb, hosszú távú mutatók a betegség-specifikus túlélés tekintetében, ahol az arányok 33% -kal és 10% -kal alacsonyabbak voltak, ami tükrözi azt a tényt, hogy a jelenlegi kemoterápiák hatékonysága korlátozott a metasztázisok megkötése utáni megakadályozásában vagy gyógyításában . 1,6
Radiológiai eredmények
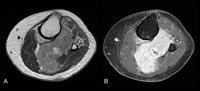
1. ábra Primer tiszta sejtes szarkóma mágneses rezonancia képalkotása.
A tiszta sejtszarkóma jellemzően mágneses rezonancia képalkotás (MRI) segítségével jellemezhető. A T1-súlyozott képek kissé hiperintenzív, homogén tumorjelet mutatnak a közeli izomszövethez képest. T2-súlyozott képek, ahol a víz erősebb jelet ad, mint a zsírszövet, a gadolínium kontrasztot követően nagy intenzitású, különösen a környező izomszövethez képest. Úgy gondolják, hogy a melanin tartalmú tiszta sejtes szarkóma megváltoztathatja az MRI jel intenzitását a többi lágyrész-daganathoz képest, bár ezek a változások nem drámaiak és nem specifikusak ahhoz, hogy önmagában képalkotó diagnózist alkossanak.
Bár a ritka általánosságban, a szinoviális szarkóma (és a Kaposi szarkóma kivételével) a 20-40 éves betegeknél a láb és a boka második leggyakoribb rosszindulatú lágyszöveti daganatáról számoltak be egyértelmű sejtszarkómáról; ezért az anatómiai elhelyezkedés és a megfigyelhető kötődés az inakkal vagy az aponeurosisokkal értékes diagnosztikai tünet lehet a tiszta sejtek szarkóma esetén 10,11 A necrosis vagy a csontos pusztulás ritkán azonosítható, ami a biopsziát megelőző malignus potenciál alulbecsléséhez vezet. 10
Ez a képalkotó technika elsősorban a különböző víz és zsírtartalmú szövetek között különböztet meg. A T1-súlyozott képek fényes jelzéseket mutatnak a zsírszövetre és alacsony jelekre, ahol magas a víztartalom. A T2-súlyozott képek az ellenkezőek, növelve a vízjelet. A csont sötét mindkét típusú MRI képen, ellentétben a sima röntgen- vagy CT-képekkel, ahol a csont fehér. Mivel a lágyszöveti daganatok általában növelik a vérellátást a növekedéshez, gyakran T2-súlyozott képeknél fokozódnak. A gadolínium kontrasztanyagot adjuk be annak érdekében, hogy tovább fokozzuk az erekben lévő víz jelét.
Bár a számítógépes tomográfia (CT) az MRI feletti hatékonysággal rendelkezik az elsődleges lágyszöveti szarkómák képalkotásában, hasznos a lokális kiújulás és a tüdőmetasztázisok monitorozása szempontjából. 12,13 A szarkómák távoli rendszerszintű metasztázisai kimutathatók egy teljes test CT és egy pozitron emissziós tomográfia (PET) kombinálásával. A PET kiemeli a tumorsejteket egy beinjektált nyomjelző anyag alkalmazásával, és a nem rosszindulatú szövetekhez képest hiperintenzív jelként jelenik meg. Ha a CT-vizsgálat PET-képekkel van ellátva, a radiológusok az egész testben megtalálhatják és megfigyelhetik a tiszta sejtszarkóma léziókat.
Patológiai vonatkozások
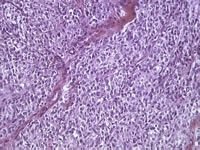
2. ábra A tiszta sejtek szarkóma morfológiai megjelenése.
A tiszta sejtes szarkóma daganatok oválisak, változatosan körülírtek és lassú növekedéssel járnak – nagyfokú metasztatikus potenciáljukkal szemben 1 Vörösesbarna-fekete-pigmentált vágott felületeket mutathatnak egy másképp jellemző szürke-sárgás háttéren 1,14 Diagnózis a tiszta sejtek szarkóma jelenleg a hisztopatológia és az immunhisztokémia (IHC) alapján történik, amelyet molekuláris tesztelés támogat (leggyakrabban a fluoreszcencia in situ hibridizáció) a melanoma differenciáldiagnózisának kizárására. 5 Tiszta sejtszarkóma tumoros minták mutatják az orsó vagy sokszög sejtek magzati növekedési mintázatát. 15-17 A citoplazma tiszta vagy eozinofil, és a sejtek kötegeit eozinofil, szálas septae vázolja.
Cellás szinten a tiszta sejtek szarkóma malignitásának mértéke megtévesztő lehet, mivel a mitotikus ábrák néha kevés olyan maggal rendelkeznek, amelyek sem hyperchromatic, sem pleomorphic, bár szövettani változatok léteznek. 1,16 Az elsődleges lágyrész-daganatok között egyedülállóan a melanoszómák előfordulása szinte minden esetben tiszta sejtes szarkóma, 1,18, amely elektronmikroszkóppal detektálható. Ennek eredményeképpen az IHC, az átlátszó sejtek szarkóma sejtjei szinte mindig pozitívak az S-100, HMB45 és melan-A melanoma markerek esetében, bár a melaninfestés nem mindig figyelhető meg. 19
A hisztopatológia a sebészi kivágású szövetminták mikroszkópos vizsgálatával magában foglalja a diagnózisokat. A patológusok gyakran képesek azonosítani a specifikus betegségeket a sejtek alakja és növekedési mintázatával. Ezt segíthet immunhisztokémia, amely magában foglalja az antitestek használatát szövetspecifikus minták festésére a beteg szövetekben kifejtett kulcsfehérjékhez annak érdekében, hogy megkülönböztessenek az egyébként mikroszkopikusan hasonló betegségektől. A FISH egy molekuláris genetikai (DNS) teszt, amelyet mikroszkóp diákokra lehet alkalmazni a génátültetések, amplifikációk vagy deléciók kimutatására olyan betegségeknél, mint például a rák, hogy nehézségekbe ütköznek a diagnózis megszilárdulása céljából.
A tiszta sejtszarkóma-daganatok a melanocitikus differenciálódás különböző szintjeit mutatják a melanocitás IHC-markerek expressziójának mértéke, a citoplazmában előkezelt melanoszómák száma és a melanin expressziója, a melanocyták által normálisan expresszált pigment az epidermisz bazális rétegében . 1.17 Nyilvánvaló sejtes szarkóma sejtekről jelenleg úgy gondolják, hogy egy idegi gerinc sejt prekurzorból származnak, mint a melanocitákkal, és nem a differenciáltabb melanocytákból. 19,20 Érdekes módon a bizonyítékok azt támasztják alá, hogy a tiszta sejtszarkóma-melanocitikus differenciálódás és transzformáció a melanocita-specifikus transzkripciós faktorok, mint például a mikrophthalmia-asszociált transzkripciós faktor (MITF) túlaktiválásából származik indirekt differenciálatlan neurális crest eredetű mesenchymalis sejtekben. 18 Ez ismét hasonlóságot mutat a melanomával, egy betegséggel, ahol a szomatikus aktiváló mutációk mellett BRAF, MITF génamplifikáció és túlzott expressziója MITF jelentették. 21 Bár MITF az amplifikációkat nem vizsgálták egyértelmű sejtszarkómában, a fő onkogén esemény a EWSR1 / ATF1 transzlokáció. 22 Így, ellentétben az anaplasztikus rákokkal, ahol az agresszivitás általában összefüggésben áll a dedifferenciálódással, a tiszta sejtek szarkóma rosszindulatú transzformációja valószínűleg a melatonocyták differenciálódási gének fokozott, de szabályozatlan szabályozása révén kapcsolódik a multipotens melanocita progenitorokban.
Idegi krónikus sejtek egyfajta mesenchymalis sejt, amely a korai embriogenezis idején a neurális csőképződésből származik. Az idegi gerinc sejtjei a test egészében vándorolnak, hogy számos szövetet, köztük a bőr melanoszómáit eredményezzenek. A tiszta sejtszarkóma hipotézise, hogy csak az idegi görcs eredetű sejtekből származik, amelyek a specifikusakat hordozzák EWSR1 / ATF1 onkogén transzlokáció.
Molekuláris genetika
A tiszta sejtes szarkóma leginkább megkülönböztető genetikai aberrációja a 12. és 22. kromoszómák kölcsönös kromoszómális transzlokációja, amely a k13 és q12 kromoszomális karokon, illetve a t (12; 22) (q13; q12) által keltett kromoszómákon fordul elő. A transzlokáció az 1. transzkripciós faktor aktiválódásának keretén belüli génfúzióját eredményezi (ATF1) és az Ewing Sarcoma Breakpoint Region 1 (EWSR1). Ezt a kromoszómális transzlokációt az 1990-es évek elején citogenetikus kariotipizálással írta le Bridge et al. 23,24 A tiszta sejtek szarkóma egyes esetekben kriptikus fúziókat hordozhat vagy alternatív partnereket használhat EWSR1, mint például CREB1, hogy hasonló onkogén változásokat okozzon. 25,26 Az utóbbi években, EWSR1 a transzlokációk bármelyikével ATF1 vagy CREB1 az elemzett esetek több mint 90% -ában megerősítették PCR és kettős színű, felszakadt FISH alkalmazásával. 16,25,27,28 Mindazonáltal Pierotti et al. azt állítja, hogy jelentős számú mély lágyszövet-esetet, melynek nincs melanóma előfordulása, rosszzanul diagnosztizálták melanoma EWSR1-transzlokáció, amikor sokan igazán egyértelmű sejtes szarkóma volt. 29 Mindkettő EWSR1-a transzlokáció-negatív esetek és a metasztatikus melanoma esetek következetesen kimutatták a 22-es kromoszómák amplifikációját.
A gastrointestinalis változat A tiszta sejtek szarkóma kikötői ugyanazokat a transzlokációkat tartalmazzák, amelyek a lágyszövet sejtsejtjeinek szérumában fordulnak elő, habár szövettani és fehérje expressziója bizonyos különbségekkel bír. A gasztrointesztinális tiszta sejtek szarkóma gyakran heterogén növekedési struktúrával rendelkezik, beleértve a szilárd, beágyazott és pszeudo papilláris mintákat egyetlen tumorban. 28 A sejtmorphológia elsősorban epithelium, kiemelkedő nucleoli-val és nagyobb számú mitotikus számokkal. A gasztrointesztinális tiszta sejtek szarkoma csak ritkán mutat festést az S-100-tól eltérő melanoma markerekre. Összefoglalva, a tiszta sejtek szarkóma gasztrointesztinális változatának ezek a jellemzői azt sugallják, hogy valószínűleg a leggyakoribb lágyszövet-variánstól eltérő betegséget jelent.
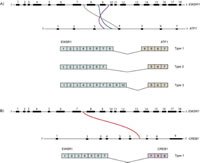
3. ábra: Gén transzlokációk és fúziós transzkriptumok világos sejtekben.
A t (12; 22) (q13; q12) több transzlokációs töréspontja eltérő kiméraforrást eredményez EWSR1 / ATF1 transzkriptumok, amelyeket a 3. ábrán vázoltak fel, melyeket PCR elemzésekkel jellemeztek, melyeket a különböző régiókra specifikus primer készleteket alkalmaztak EWSR1 / ATF1. A három leggyakoribb fúziós transzkripciós variánst a Panagopoulos részletesen leírja et al. (2002), amelyek mindegyike különböző genomikus töréspontokkal rendelkezik a EWSR1 és a ATF1 géneket. 30 bp 1 és 2 messze a leggyakoribb fúziós transzkripciós variánsok, amelyek a tiszta sejtes szarkóma esetében találhatók. 30,31
Napjainkig két különálló partner gén megfigyelés alatt állt EWSR1 világos sejtes szarkómában, ATF1 mint a gyakoribb. Antonescu et al. (2006) először a EWSR1 val vel CREB1, egy közeli homológ ATF1, gasztrointesztinális tiszta sejtes szarkóma betegmintákban. 28 Mások leírják a EWSR1 / CREB1 a gyomor-bél traktuson kívüli helyeken előforduló változat, beleértve a hagyományos, tiszta sejtes szarkómára jellemző perifériás lágy szöveteket is, 16,25-27-re, ami az eredeti meggyőződést támasztja alá, hogy ez a változat a gyomor-bél traktusra jellemző. Ezzel ellentétben az EWSR1 / ATF1 variáns primer helyen található a gyomor-bél traktusban. Ez a kevésbé gyakori fúziós változat a tiszta sejtes sarcomában hasonlít a. Típusú 2. Fúziós variánssal EWSR1 / ATF1 amelyet Panagopoulos ír le et al. Tekintettel a homológia között ATF1 és CREB1, fúziója EWSR1 hogy ezeknek a géneknek mindegyike hasonló onkológiai hatásokat mutathat a betegség biológiájára nézve.
Kevés más következetes genetikai mutációról számoltak be tiszta sejtes szarkómában. Citogenetikailag azt találták, hogy az azonosítható t (12; 22) hiányzó esetek alkalmanként 22-es kromoszómát tartalmaznak. 23,24 A triszómiát 8, és ritkábban a triszómiát 2 és a triszómiát 7 is megfigyelték, hogy konzisztens, nem véletlenszerű kromoszómális változásokat eredményeznek a tiszta sejtek szarkómájában. Az EWSR1 / ATF1-et expresszáló t (12; 22) (q13; q12) transzlokáció még nem bizonyult véglegesen bizonyítottan felelős a celluláris transzformációért a tiszta sejtszarkóma iránt; Ezzel ellentétben a Ewing családba tartozó tumor fúzió EWSR1 / FLI1, ha csontvelő eredetű primer mesenchymális őssejtekben expresszálódik, alkalmas arra, hogy Ewing-családba tartozó tumorszerű tulajdonságokkal transzformálódjon a sejtekbe. 8,9 Összehasonlításképpen az EWSR1 / ATF1 expresszió csontvelő eredetű mesenchymális progenitor sejtekben nem elégséges transzformációra és tumor növekedésre xenograftált egerekben, ami azt sugallja, hogy az EWSR1 / ATF1 expresszálása a megfelelő sejtes kontextusban (esetleg szükségessé teszi a neurális crest- szükségessé válhat. 33
EWSR1 / ATF1 fehérje szerkezete és funkciója
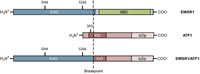
4. ábra: Az EWSR1 / ATF1 fehérje szerkezete.
A tiszta sejtes szarkóma keretein belüli t (12; 22) (q13; q12) transzlokációja olyan jellegzetes fúziós onkoproteint kódoló transzkriptumokat generál, amelyek hasonlóak a Ewing-családba tartozó daganatokban, a dezmoplasztikus kis kerek sejtdaganatban, extraszeletes myxoid chondrosarcomában expresszált változatokban a myxoid liposarcoma. Ezek a tumorok mindegyike kiméra fehérjét expresszál, ahol az EWSR1 egy másik transzkripciós faktor DNS-kötő doménjéhez van fuzionálva. Az EWSR1 / ATF1 fúziós onkoproteinről azonban még keveset ismertek célgénjeik tekintetében, kivéve a MITF gén.
Fontos bepillantások származhatnak az EWSR1 és az ATF1 fehérjefunkcióinak és kölcsönhatásainak azonosításában nem malignus normális szövetekben és tumorsejtvonalakban. A natív EWSR1 fehérje funkciója nagyrészt elhanyagolható, de számos tanulmány kimutatta, hogy egyidejűleg egyaránt hatékony transzkripciós aktivátor és represszor lehet. A 4. ábrán bemutatott EWSR1 fehérje szerkezet egy 35,36 C-terminális RNS-kötő domént és egy EAD (EWSR1 aktivációs domén) nevű N-terminális aktivációs domént tartalmaz. 36 Korábban “molekuláris tépőzár” néven ismertetett módon az EAD bonyolult, rendezetlen struktúrával rendelkezik, amely bizonyos transzkripciós aktivációs doméneket idézi, és képes legalább (legalább tranziens) kötődni az emberi proteomban lévő 100 fehérjéhez. 37
Transzkripciós tényezők olyan fehérjék, amelyek a gén expresszióját szabályozó DNS promoter régióihoz kötődnek. A transzkripciós faktorok elkülönített struktúrákat (DNS-kötő doméneket) tartalmaznak, amelyek a különböző felismerési szekvenciák felismerésében vesz részt. Az EWSR1 önmagában nem transzkripciós faktor, és nem állt szándékában DNS-kötést; az EWSR1 / ATF1 fúzió abnormálisan azonban képes arra, hogy kötődjön és szabályozza az ATF1 célgéneket, amelyeket rendszerint nem kellene alkalmazni.
Protein-fehérje kölcsönhatásokA DNS-kötődés mellett a fehérjék más fehérjéket is kötnek a specifikus kölcsönhatásokon keresztül, amelyek a fehérjekötő domének között fordulnak elő. A fehérje-fehérje kölcsönhatásoknak sok funkciója van; például a fehérjék kötődnek és kölcsönhatásba lépnek a sejtmembrán és a sejtmag közötti jelek továbbítására annak érdekében, hogy stimulálják a sejtnövekedést és a fejlődést, ami általában túlzottan aktivált téma a rákban. Bizonyos fehérjék csak olyan összetevőkben funkcionálnak, amelyek több, egymáshoz kötött proteinből állnak, mint például az ATF1 és a CREB1. Más fehérjék molekuláris állványokként működnek, amelyek szorosan kapcsolják össze azokat a fehérjéket, amelyek egyébként nem kölcsönhatásba lépnek, így lehet, hogy az EWSR1 / ATF1 fúziós onkoprotein erősen aktiválja a transzkripciót.
A natív ATF1, a CREB transzkripciós faktor család tagja, egy CREB1-vel heterodimerizáló transzkripciós ko-aktivátor. Mindkettő specifikus DNS-szekvenciákat köt meg cAMP válasz elemekkei (CREs), amikor az intracelluláris cAMP-szintek nőnek a sejtjelző útvonalak következtében. 38,39 A nettó eredmény az emberi genomban elterjedt cAMP-indukálható gének aktiválása. Az ATF1 és a CREB1 aktivitás normális szabályozási tartománya részben hiányzik a tiszta sejtszarkóma fúziós onkoproteinekben, ami azt jelenti, hogy a cAMP szintek már nem megfelelően szabályozottak. Az ATF1 megmaradt része egy DNS-kötő domént (a bZip-nek nevezünk), amely felelős a CRE szekvenciák gén promóterekben. A 38,41 bZip domének széles körben elterjedtek a DNS-kötő fehérjékben, beleértve az ATF / CREB családot. 38 Az EWSR1 aktivációs tartománya hatékonyan megkötődik CRE-amely az ATF1 DNS-kötő doménjéhez történő fúzió útján tartalmazza a promotereket.
A tiszta sejtek szarkóma EWSR1 / ATF1 fúziós onkoproteinét feltételezték, hogy hatásos CRE-az EWSR1 potenciális transzkripciós aktivációs doménje miatt, és a génexpressziós profil adatainak számítási analízise támogatja ezt a koncepciót. A normál sejtekben az ATF1 célgének transzkripcióját számos kináz szabályozza. Például a protein kináz A foszforilálja ATF1 és CREB1 kináz indukálható doménjeiket, ami a célzott gének aktiválódását eredményezi a CREB kötő fehérjével (CBP) való kötődés révén. A CBP képes közvetlenül megváltoztatni az epigenetikus kódot a kromatinban hiszton acetilezéssel, hogy megkönnyítse a génexpressziót. 40,41 Nyilvánvaló, hogy az ATF1 kinázindukálható doménjének kontroll régiója elveszik az EWSR1 / ATF1 fúziós onkoproteinben (4. ábra), és feltételezhető, hogy a fúzió ATF1 régiója nem felelős a CBP-kötődésért az EWSR1 / ATF1-ben . Hasonlóképpen, a CREB1 teljes kinázindukálható doménje elveszett az EWSR1 / CREB1-ben. Az EWSR1 / ATF1-nek a CBP-vel való kölcsönhatása számos tanulmányban igazolt, bár a kötés pontos helyét még meg kell erősíteni. 41,43 A bizonyítékok azt mutatják, hogy a CBP kölcsönhatásánál szükség van a 83-227 aminosavak közötti EWSR1 régióra, amely lizin acetilációs helyet (GNK, 4. ábra) tartalmaz. Az acetilezett lizinekről ismert, hogy kölcsönhatásba lépnek a bromodomainok nevű fehérje doménekkel. A CBP-nek ismerten bromodomain van, amely az acetilezett lizinekhez (44) kötődik; így lehetséges, hogy a CBP kölcsönhatásba lép az EWSR1 / ATF1 enzimmel az acetilezőhelyen.
Az epigenetika szerepe a rákban az aktív kutatás viszonylag friss területe. A fehérjék, mint a HDAC, a Polycomb, a CBP és a DNS-metil-transzferáz kémiailag módosítják a DNS-t és a hisztonokat oly módon, hogy nem változtatják meg a DNS-szekvenciát. Ezek a változások magukban foglalják a hiszton acetilezést és a metilezést és a DNS-metilezést, és úgy gondolhatjuk, hogy egy módú sejtek határozzák meg, hogy mely géneket kell be- vagy kikapcsolni adott időpontban egy adott szövetben. Az epigenetikai programozás zavara számos betegséghez vezethet, beleértve a rákot is. Néhány transzlokációhoz társuló szarkóma (például szinoviális szarkóma) képes megváltoztatni az onkogén transzformációhoz vezető fontos gének epigenetikáját, és ezáltal szabályozhatja azokat.
Azt jelentették, hogy a 266. szerin foszforilációja a 4. ábrán bemutatott EWSR1 / ATF1 EWSR1 részében kulcsfontosságú a transzkripciós aktiváláshoz. 45 Olsen és Hinrichs által készített tanulmány szerint a 266 szerin megzavart foszforilációja csökkentette az EWSR1 / ATF1 kötődését CRE szekvenciákat. Arra a következtetésre jutnak, hogy a 266 szerin az EWSR1 / ATF1 molekuláris jellemzője a DNS-hez való kötődéshez és a transzaktivált transzkripcióhoz. Az EWSR1 / ATF1 ezen szerkezeti jellemzőinek megértése megakadályozhatja az új célzott kezelések kifejlesztését a tiszta sejtek szarkóma, valamint a számos hasonló szarkóma hasonló EWSR1 transzlokációval.
A transzkripció-szabályozó fehérje komplex
Úgy gondolják, hogy az EWSR1 kölcsönhatásba lép számos transzkripciós ko-aktivátor fehérjével. 36 Ez részben megmagyarázza az EWSR1 / ATF1 képességét, hogy erősen aktiválja a cAMP által indukálható géneket a tiszta sejtek szarkómájában, amely fehérjeállványként működik más transzkripciós ko-aktivátorok számára. A SOX10 és a CBP elsődleges jelöltek, mint transzkripciós aktivációs komplex partnerek az EWSR1 / ATF1 enzimmel, ami a downstream onkogének túlaktiválódását okozza. Tény, hogy a SOX10 az EWSR1 / ATF1 legfontosabb fehérje kofaktora lehet a MITF tiszta sejtes szarkómában 18, mivel a SOX10 javul MITF kifejeződést nem malignus sejtekben, míg a SOX10 kimerülése tiszta sejtes szarkómában dózisfüggő kimerüléshez vezet MITF még az EWSR1 / ATF1 jelenlétében is. Együtt, ezek az eredmények azt sugallják, hogy a SOX10 szükséges MITF kifejezést, és hogy az EWSR1 / ATF1 a SOX10-gyel együtt működik magas szintű vezetéshez MITF onkogén expresszió tiszta sejtes szarkómában.
SOX10 egy kritikus transzkripciós faktor, amely az idegi törzsvonal nem differenciálódott sejtjeiben expresszálódik. Ezért az a tény, hogy a tiszta sejtszarkóma sejtek is expresszálják a SOX10-et, támogatja azt az elméletet, miszerint a tiszta sejt-szarkóma idegi krónikus sejtekből származik. Ezenkívül, ha a hatóanyag a SOX10 aktivitását célozza meg, akkor a tiszta sejtek szarkóma sejtjei szelektíven meghalnak, míg a nem rosszindulatú sejtek felnőtteknél nem változnak.
Másrészről lehetséges, hogy az EWSR1 / ATF1 a represszor fehérjéknek a célgenerátorokhoz való toborzásával is képes közvetíteni a transzkripciós repressziót, hasonlóan a Egr-1 az SS18 / SSX onkoprotein synovialis szarkóma általi elnyomás. 46,47 Egr-1 egy SS18 / SSX által célzott tumorszuppresszor gén az ATF2-vel való kölcsönhatása révén (az ATF1 szoros homológja), a hiszton-deacetilázokkal (HDAC-k) és a Polycomb-proteinekkel való további kölcsönhatások által közvetített represszióval. Bár az EWSR1 / ATF1 eddig csak kimutatták, hogy közvetíti a transzkripciós aktivációt, számos tanulmányban olyan hasonló fúziós transzkripciós faktorokat és kapcsolódó komplexeket írtak le, amelyek képesek aktiválni vagy elnyomni a transzkripciót a célzott géntől és a toborzott kofaktoroktól függően. Az egyik lenyűgöző példa az akut myelogenous leukémia, amely kifejezi a fúziós onkoprotein AML1 / ETO-t. 48 A szinoviális szarkóma SS18 / SSX-hez hasonlóan, az AML1 / ETO komplexek egy DNS-kötő fehérjével, hogy lokalizálják a gén promótereket és közvetítik a transzkripciós repressziót ko-represszorokon és HDAC-kon keresztül. Azonban, mint a tiszta sejtes szarkóma esetében, az akut myelogén leukémia fúziós onkoprotein szintén kötődik a CBP / p300 transzkripciós aktivátorhoz, amely génaktiválást jelez. Annak ellenére, hogy egy hasonló mechanizmust még egyértelműen sejtes szérumban bizonyítottak, egyesek CRE-amelyek tartalmazzák a célgéneket, például a kettős specificitású foszfatáz 1-t, ismert, hogy a sejtek szarkóma egyértelműen szabályozott.
Az EWSR1 / ATF1 onkogén céljai
A gén-expressziós profil és az IHC-adatok valóban felismerték számos jól ismert onkogén abnormális felszaporodását tiszta sejtszarkómában, mint például a növekedés / túléléshez kapcsolódó receptor tirozin kinázok c-Kit, c-Met és ERBB3, a anti-apoptotikus szabályozó fehérje BCL-2, az idegi crest-specifikus SOX10 transzkripciós faktor és a MITF melanocitikus mesterkriptáz-faktor. 16,18,42,49,50 Ezek a gének számos rákos megbetegedésben vannak érintettek, mivel szabályozzák a szabályozatlan növekedéshez, invázióhoz és angiogenezishez hozzájáruló sejtjelző útvonalak közös halmazát.
Génkifejezés profilozása lehetővé teszi a kutatók számára, hogy megfigyeljék a nagyszámú (1000+) gén kifejeződésének szintjét biopsziás vagy tenyésztett szövetmintákban, DNS-mikroarray-k alkalmazásával. A rákos szövetből származó expressziós profilokat hasonlítjuk össze az azonos páciens normál szövetével és / vagy a rák eredeti szövettípusával annak érdekében, hogy megértsük, hogy a különbségek hogyan hatnak az onkogénre. Ez egy nagyon vonzó módszer a jobb diagnosztikai biomarkerek felfedezésére (bizonyos betegségek genetikai jelölése) és személyre szabott, célzott terápiák alkalmazására.
Kevés, ha ezen onkogének bármelyike bizonyítottan közvetlen célpontja az EWSR1 / ATF1, a MITF. Sőt, a MITF a promóter a CRE amelyet megerősített az EWSR1 / ATF1 és egy közeli SRY hely, amelyet a SOX10 kofaktor köti össze, együttesen nagymértékben fokozza az expressziót. 18 Ezek a szerzők ezenkívül megmutatták MITF expresszió szükséges mind a melanocitikus differenciálódáshoz, mind a tiszta sejtszarkóma tumorsejtek túléléséhez in vitro . Az EWSR1 / ATF1 megkötésével a kötő DNS-ből és a transzkripció aktiválásából megfigyelték az MITF célgének csökkent expresszióját, a tirozináz aktivitás csökkenését (melanin bioszintézis sebességének korlátozó lépése) és a tiszta sejtek szarkóma túlélésének és proliferációjának drasztikus csökkenését. Azonban Li et al. hogy egy szintetikus MITF Tiszta sejtszarkóma vagy melanoma sejtekbe bevezetett promóter nem volt képes aktiválni az EWSR1 / ATF1-et, esetleg az epigenetikus vagy kofaktor kontextusbeli különbségeket tükrözve. 51
EWSR1 / CREB1 és EWSR1 / ATF1 fúziók más tumorokban
CREB1 és ATF1 65% -ban azonosak egymással, és megtartják a hasonló exonokat onkogén fúziókban. A gén expressziós profilja azt mutatja, hogy a gasztrointesztinális variáns tiszta sejtszarkóma mintákat expresszál EWSR1 / CREB1 fúzió, nem expresszálnak tipikus melanocitikus differenciálódási géneket, bár expresszálnak SOX10 összehasonlítható szinteken a lágyszöveti variáns tiszta sejtes szarkóma kontroll szövetekhez. 28
Angiomatoid fibrous histiocytoma, celluláris morfológiájú lágyszöveti tumor, génexpressziós profil és klinikai prognózis drasztikusan különbözik a tiszta sejtek szarkómájától. EWSR1 / ATF1 áttelepítések. 52 Az angiomatoid fibrous histiocytoma sokkal jobb prognózissal rendelkezik, mint a tiszta sejtes szarkóma: míg a lokális recidíva a betegek legfeljebb 10% -ánál jelentkezik, a metasztázisok nagyon ritkák.
Angiomatoid fibrous histiocytomas hasonlóan a tiszta sejtszarkómahoz, mivel általában a fiatal felnőttek disztális végkoncentrációiban szenvednek, de szövettanilag különböző storiformis mandulasoros neoplasmák, amelyek vérben töltött cisztikus tereket tartalmaznak, nyirokcsomókkal körülvéve, amely a szubkután szövetekhez kötődik, nem pedig az inakhoz. 52 Továbbá, nem mutatnak szignifikáns kifejezést a MITF, GP100, CDK, vagy TALÁLKOZOTT az IHC-vel szemben, ellentétben a tiszta sejtszarkómával. A szövettan, az IHC és a klinikai megjelenítés irányítja az angiomatoid fibrous histiocytomára vonatkozó diagnózist, még akkor is, ha egy EWSR1 / ATF1 vagy EWSR1 / CRE a transzlokációt azonosították.
Érdekes, Antonescu et al. hogy az angiomatoid fibrous histiocytomasok többsége ténylegesen hordozza EWSR1 / CREB1 inkább mint EWSR1 / ATF1 fúziók. A gén expressziós adatai azt mutatják, hogy az angiomatoid rostos hisztokocitó nem expresszálódik SOX10, ellentétben a tiszta sejtes szarkómával. Míg a tiszta sejtszérum a melanómával kapcsolatos gének szignifikáns expresszióját jelzi, sem az angiomatoid fibrous histiocytoma, sem a gasztrointesztinális tiszta sejtek szarkóma nem expresszálja ezeket a géneket. Lehetséges, hogy ez a két genetikailag hasonló daganat különféle progenitor sejtekből származik (nem neurális gerinc), mint a tiszta sejtes szarkóma.
A Clear Cell szarkóma jelenlegi és jövőbeni kezelése
A tiszta sejtek szarkóma jelenlegi kezelése korlátozott, sok központban, széles sebészeti kivágáshoz és sugárterápiához. A tiszta sejtek szarkóma-daganatoknak csak kis százalékában van a legjobb esetben parciális válasz vagy stabil betegség a hagyományos citotoxikus kemoterápiás kezelések után. 6 Azonban a szabályozott onkogének c-Kit, c-Met és ErbB3 tiszta sejtszarkómában azonosítottak, hogy a receptor tirozin-kináz inhibitor gyógyszereket, mint a szunitinib, crizotinib és EGFR-inhibitorok érdemes megvizsgálni.
Kemoterápia versus célzott terápia
Fontos megjegyezni a különbséget a hagyományos kemoterápia és a célzott terápia között. A kemoterápiás gyógyszerek hatásosan befolyásolják a sejteket, és ezért nem célozzák meg a rákos sejteket, jóllehet a rákos sejtek sokkal nagyobb arányban oszlanak meg aktívan, mint a legtöbb rosszindulatú sejt. Tehát a kemoterápiák a leginkább a gyorsan növekvő rákos megbetegedéseken dolgoznak, de mellékhatásaik vannak a nem rosszindulatú sejtek, például a vér és immunsejtek (amelyek vérszegénységhez és immunszuppresszióhoz vezetnek), valamint a szőrtüsző sejtjeinek (amely alopéciához vezet) aktívan elosztva. A célzott terápiák különböznek abban a tekintetben, hogy csak olyan specifikus molekuláris célpontok ellen hatnak, amelyek a tumorigenezist a specifikus onkogén hatások visszafordítására fordítják. Az ilyen terápiák elméletileg javulást mutatnak a kemoterápiával szemben, mivel várhatóan megállítják és visszafordítják a rákot okozó pontos molekuláris eseményeket (pl. Konstitutívan aktív jelzőfehérje), nem csupán ezeknek az eseményeknek az eredménye (pl. Kontrollálatlan növekedés és szétválás).
Receptor tirozin-kináz inhibitorok
A receptor tirozin-kinázok proliferatív jeleket továbbítanak az atommagnak, amelyek általában túlságosan erősen fordulnak elő a ráksejtekben, és így gyorsabban nőnek és oszlanak el. A receptor tirozin-kináz inhibitorok megakadályozzák a rákos sejtek növekedését, amelyek receptor-tirozin-kinázok által aktivált proliferatív jelátvitelhez kapcsolódnak.
A sunitinibet, vérlemezke-eredetű növekedési faktor receptor (PDGFR), az érrendszeri endoteliális növekedési faktor receptor (VEGFR) és a c-Kit, a ráksejtek proliferációjához hozzájáruló receptor-tirozin-kinázok multinukin inhibitora az FDA a vese sejtek karcinóma és emésztőrendszeri stroma tumor, 54, és még mindig a II. fázisú klinikai vizsgálatokban van a többi szilárd tumor széles körének kezelésére. 55,56 Egyetlen, tiszta sejtes szarkóma tumorral rendelkező betegnek csak két hónapos szunitinib-kezelés után dokumentálták részleges reakcióját (a legtöbb sérülés méretének csökkenése és csökkent tumor sűrűsége). 57
2012-ben az FDA jóváhagyta a PDGFR / VEGFR / c-Kit inhibitort pazopanibbal a lágyrészek szarkóma kezelésére, amely sikeres volt a sejtvonal- és xenograft növekedés gátlásában egyes lágyrész-szarkóma modellekben, valamint részleges válaszokban és tolerálható toxicitásban a II. fázisú klinikai vizsgálatokban. 58-60
Talán a legígéretesebb receptor tirozin-kináz-inhibitorok a tiszta sejtek szarkóma számára azok, amelyek a MET-et célozzák meg, az MITF downstream célpontja, amely tiszta sejtes szarkóma által szabályozott. Egy fázis II. Klinikai vizsgálat, a MET inhibitort alkalmazva ARQ 197 a világos sejtes szarkóma befejeződött, 61 és egy nagyon közelmúltbeli (2012. január) keresztdaganatos II. fázisú klinikai vizsgálat, beleértve a tiszta sejtes szarkómát is, a MET inhibitor crizotinib. 62
Kis molekulájú inhibitorok
A downstream onkoproteineket célzó alternatíva az olyan gyógyszerek kifejlesztése, amelyek az EWSR1 / ATF1 ko-aktivátor kölcsönhatásait célozzák meg, mint például a SOX10 és a CBP. 18,41,50,51 Jelenleg számos olyan kismolekula-ellenes hatóanyag van, amelyek megzavarják a CBP és a CREB1 kölcsönhatását, de hogy ez megakadályozza-e az EWSR1 / ATF1 vagy EWSR1 / CREB1 kötődést a CBP-ből, nem ismert. 63,64 A CBP / p300 acetiltranszferáz aktivitást megakadályozó más inhibitorok, mint például a Lys-CoA-Tat és a C646, jelenleg vizsgálatban vannak. Wang et al. hogy a Lys-CoA-Tat és a C646 szignifikánsan gátolja az akut myelogenous leukémia sejtvonalak növekedését, valamint csökkenti a transzplantált tumorsejtek túlélését in vivo (48 Bár az EWSR1 / ATF1 gén aktiválódásának onkogén hatását megakadályozó CBP / p300 inhibitorok hatásos terápiák lehetnek tiszta sejtes szarkóma és hasonló lágyszöveti szarkómák esetében, ilyen vizsgálatok nem publikáltak. olyan kis molekulájú gyógyszerek, amelyek specifikusan gátolják a SOX10 fokozó aktivitást, ami elméletileg gátolhatja a SOX10 aktiválását számos idegi gerincspecifikus onkogén útvonalon, és így gátolhatja a rák előrehaladását.
HDAC inhibitorok
Szinoviális sarcomában, Su et al. jellemezte, hogy az SS18 / SSX hajtja az onkogént, és kimutatta, hogy a HDAC-inhibitorok célozzák és megfordítják az SS18 / SSX onkoprotein hatását, szinoviális szarkóma sejtekben in vitro. Érdekes módon a HDAC-inhibitorok hasonló vagy nagyobb hatékonyságot mutattak a tiszta sejtes szarkóma sejteknél in vitro, a látszólagos érzékenység szintje nagyobb, mint a többi vizsgált szarkóma, a nem malignus mesenchymalis sejtek, a hematopoietikus és az epitheliális rosszindulatú daganatoké, ami azt jelenti, hogy a fúziós onkoprotein tiszta sejtszarkómában a célzott gének HDAC által közvetített epigenetikus programozásán keresztül hathat (mint a szinoviális sarcomában) . A 65-es HDAC-inhibitorok a bőr T-sejtes limfóma számára engedélyezettek, és klinikai vizsgálatokban viszonylag alacsony toxicitást mutattak. 66-68
Mi az a HDAC?
A hiszton-dezacetilázok (HDAC-k) olyan enzimek, amelyek eltávolítják a hisztonokból egy acetilcsoportot tartalmazó kémiai szerkezetet. A hisztonok a kromatin fő strukturális fehérjei, amelyek körül a DNS kettős spirális szálát feltörik, hogy a genetikai kódot a sejt magjába tömörítse. A hisztonok acetilezésének HDAC-k általi megváltozása az egyik módja annak, hogy a kromatin szerkezete módosulhat a gén-transzkripció elősegítése vagy megakadályozása érdekében. A HDAC-k képesek meghajtani oncogenesisre az acetilcsoportok eltávolításával a tumorszuppresszor gének lekapcsolására.
A HDAC inhibitorok MS-275 és romidepsin mindkettőnek azt találták, hogy az elnyomását okozza EWSR1 / ATF1 és célját MITF három tiszta sejtes szarkóma sejtvonalban 65 és mások azt mutatták, hogy a HDAC-inhibitorok, a nátrium-butirát, a trikosztatin A és a suberoylanalid-hidroxámsav (SAHA, vorinostat) MITF. 72 Ezek a vizsgálatok többek között tudományos támogatást nyújtottak a szarkómákban a HDAC inhibitorokat tesztelő klinikai vizsgálatokhoz.
5. ábra Az EWSR1R1 / ATF1 által közvetített három modell.
A tiszta sejtek szarkóma HDAC-gátlásának különös érzékenységére vonatkozó mechanikai magyarázatokat jelenleg vizsgálják. Akut myelogenous leukémia esetén az AML1 / ETO fúziós onkoprotein számos célt elnyomott, de az onkogének egy részhalmazát aktiválja a CBR transzkripciós ko-aktivátor felvételével. Így tehát ez a fúziós onkoprotein teljesen ellentétes transzkripciós hatást mutat a promótertől és az általa megkötött fehérjéktől függően. Hasonlóképpen, az SP1 fehérjekomplexet, amelyet általánosságban transzkripciós aktivátornak is ismert, azt találták, hogy represszorokat vesz fel egyes promoterekhez HDAC-k segítségével. 69 így, bár az EWSR1 / ATF1 általában a transzkripció aktivátorának tekinthető, a tiszta sejtes szarkóma fúziós onkoprotein valójában részt vehet a kritikus tumorszuppresszor gének repressziójában, a transzkripciós ko-represszorok ilyen promotereken történő alternatív kötésével; A HDAC-inhibitorok segíthetnek a tumorszuppresszor gének újraaktiválásában. A HDAC-inhibitorok alternatív módon jól működhetnek tiszta sejtszarkómában az EWSR1 / ATF1 szabályozóinak újraaktiválásával, másodlagosan ellensúlyozva onkogén hatását. A harmadik lehetőség az, hogy az EWSR1 / ATF1 kritikus funkciója a downstream tumorszuppresszor gének represszorának aktiválása, amely a represszor hatását a HDAC inhibitorokkal megfordítja. Ez az elrendezés hasonlítana az EWSR1 / FLI1 által közvetített, az NKX2.2 represszor Ewing-családba tartozó daganatokban történő EWSR1 / FLI1 által közvetített korrigálására, 70 ahol az NKX2.2 és a HDAC-ok által közvetített EWSR1 / FLI1 onkoprotein nettó hatása elnyomja a kritikus differenciálódást vagy tumorszuppresszor gének, amelyek feltételezhetően aktívak. További spekulatív lehetőségek léteznek a kromatin komplexitása és a hiszton- és DNS-modifikáló fehérjék epigenetikus kontrollja alapján. Végső soron a részletes molekuláris kísérleteknek meg kell tudniuk különböztetni ezeket a lehetőségeket, megmagyarázva a HDAC inhibitor hatásmechanizmusát és tájékoztatni a terápiás stratégiák lehetséges javulását.
Következtetés
A tiszta sejtszérum a fiatal felnőttek rosszindulatú daganata, akiknek rossz a hosszú távú túlélési arányuk, nagyrészt azért, mert nem reagál a jelenlegi kemoterápiákra. A diagnózis elsősorban az IHC-festés által támogatott biopsziás szövettani vizsgálaton alapul, gyakran az EWSR1 / ATF1 vagy annak variánsainak molekuláris tesztjei miatt, ami kizárja a rosszindulatú melanoma gyakoribb differenciáldiagnózisát. E fúziós onkoprotein közvetlen inhibitorai még nem állnak rendelkezésre, de a tiszta sejtek szarkóma és a kapcsolódó transzlokációhoz társuló szarkóma biológiájának molekuláris megismerése célzott terápiákhoz vezethet, amelyek közül néhányat már értékelnek.
E cikk teljes címe az idézéshez: “A genetika, a molekuláris biológia áttekintése, meglévő és kísérletes kezelése a puha szövet szövettana.”
Utolsó felülvizsgálat és orvosi felülvizsgálat: 6/2012
Által Garrett Barry
és Torsten O. Nielsen, PhD
Patológiai és Laboratóriumi Orvostudományi Kar
British Columbia Egyetem
Vancouver Kórház Egészségtudományi Centrum
Vancouver, BC, CANADA
1. Speleman R és Sciot F. 2002. A lágyszövet sejtjeinek világos sejtje. Ban ben Egészségügyi Világszervezet A daganatok osztályozása A puha szövet és csont tumorok patológiája és genetikája, ed. C Fletcher, K Unni, F Mertens, 211-212. Lyon: IARC Press.
2. Sebire NJ és Vujanic GM. 2009. gyermekgyógyászati vese tumorok: a legújabb fejlemények, új entitások és patológiai jellemzők.Kórszövettani 54: 516-528.
3. Enzinger FM. 1965. Tendons és Aponeuroses Clear-Cell Sarcoma. 21 eset elemzése. Rák 18: 1163-1174.
4. Curry CV, MK diszkosz, Hicks MJ, Naeem R, Reed JA és López-Terrada DH. 2008. Lágyszövet sejtjeinek világos sejtje: a fluoreszcencia diagnosztikai alkalmazhatósága in situ hibridizációs és reverz transzkriptáz polimeráz láncreakció. A bőrbetegségekről szóló folyóirat 35 (4): 411-7.
5. Tanas MR, Rubin BP, Tubbs RR, Billings SD, Downs-Kelly E és Goldblum JR. 2010. A fluoreszcencia hasznosítása in situhibridizáció a 230 mesenchymális daganat diagnózisában: intézményi tapasztalat. A patológia archívuma laboratóriumi gyógyszer 134 (12): 1797-803.
6. Jones RL, Constantinidou A, Thway K, Ashley S, Scurr M, Al-Muderis O, Fisher C. et al. 2010. Kemoterápia tiszta sejtes szarkómában. Orvosi onkológia: 859-863.
7. Capecchi MR, Lessnick SL, Haldar M, Hancock JD és Coffin CM. A szinoviális szarkóma feltételes egérmodellje: a myogén eredetre vonatkozó megismerések. Rákos sejt 11 (4): 375-88.
8. Riggi N, Suva M-L, Suva D, Cironi L, Provero P, Tercier S, József J-M, et al. Az EWS-FLI-1 expresszió kiváltja az Ewing-féle primer humán mesenchymalis őssejtekben a sarcomai iniciációs programot. Rákkutatás 68 (7): 2176-85.
9. Riggi N, Cironi L, Provero P, Suva M-L, Kaloulis K, Garcia-Echeverria C, Hoffmann F, Trump A és Stamenkovic I. 2005. Ewing-féle sarcoma kialakulása primer csontvelő eredetű mesenchymális progenitor sejtekből. Rákkutatás65 (24): 11459-68.
10. Stacy GS és Nair L. 2007. A bizonytalan differenciálódás végtag szarkóma mágneses rezonancia képalkotó jellemzői.Klinikai Radiológia: 950-958.
11. Kransdorf M. 1995. A malignus daganatok egy nagy referral populációval: a diagnózisok megoszlása kor, nem és hely szerint.American Journal of Roentgenology 164 (1): 129-134.
12. Ricard F, Cimarelli S, E. Deshayes, Mognetti T, Thiesse P és Giammarile F. 2011. Az F-18 FDG PET / CT további haszna a gyermekgyógyászati rhabdomyosarcoma kialakulásában és nyomon követésében. Klinikai nukleáris medicina 36 (8): 672-7.
13. Terazawa K, Otsuka H, Morita N, Yamashita K és Nishitani H. 2009. A vékonybél clear cellás szarkóma, amelyet az FDG-PET / CT kimutatott a gyulladásos reakció átfogó vizsgálata során. Az orvosi vizsgálat folyóirata 56 (1-2): 70-5.
14. Dim DC, Cooley LD és Miranda RN. 2007. Áttetsző sejt-szarkóma az inak és aponeuroses: a felülvizsgálat. A patológia archívuma laboratóriumi gyógyszer 131 (1): 152-6.
15. Meis-Kindblom JM. 2006. Az inak és az aponeuroses sejtes sarcomája egyértelmű: egy történelmi perspektíva és tisztelgés az entitás mögött álló emberhez. Előrehaladások az anatómiai patológiában 13 (6): 286-92.
16. Hisaoka M, Ishida T, Kuo T-T, Matsuyama A, Imamura T, Nishida K, Fukuda T és Hashimoto és H. 2008. A puha szövet szöveti szarkóma egyértelműen 33 klinikai, immunhisztokémiai és molekuláris analízis. American Journal of Surgical Pathology 32 (3): 452-460.
17. Antonescu CR, Tschernyavsky SJ, Woodruff JM, Jungbluth Aa, Brennan MF és Ladanyi M. 2002. Tiszta sejtek szarkóma molekuláris diagnózisa: EWS-ATF1 és MITF-M transzkriptumok detektálása és 12 eset kórszövettani és ultrastrukturális analízise. A molekuláris diagnosztika folyóirata 4 (1): 44-52.
18. Fisher DE, Davis IJ, Kim JJ, F Ozsolak, Widlund HR, Rozenblatt-Rosen O, Granter SR, et al. 2006. Oncogén MITF diszreguláció tiszta sejtes szarkómában: meghatározza a humán rákok MiT családját. Rákos sejt 9 (6): 473-84.
19. Chung F és Enzinger E. 1983. Lágy részek malignus melanoma. Tiszta sejtszarkóma újraértékelése. American Journal of Surgical Pathology 7 (5): 405-413.
20. Segal NH, Pavlidis P, Noble WS, Antonescu CR, Viale A, Wesley UV, Busam K. et al. 2003. A Clear-Cell Sarcoma mint Melanoma altípusának genomikai profilozás szerinti osztályozása. A klinikai onkológia lapja 21 (9): 1775-1781.
21. Eladók WR, Fisher DE, Garraway LA, Widlund HR, Rubin MA, Getz G, Berger AJ, et al. Az integratív genomikai vizsgálatok az MITF-et azonosítják, mint a túlélési onkogén malignus melanoma által amplifikált. Természet 436 (7047): 117-22.
22. Panagopoulos I, Mertens F, Isaksson M és Mandahl N. 2005. A BRAF gén mutációinak hiánya a puha részek rosszindulatú melanómiájában (tiszta sejtes szarkóma ín és aponeurosis). A rák genetikája és citogenetikája 156 (1): 74-6.
23. Bridge J, Sreekantaiah C, Neff J, és Sandberg A. 1991. Citogenetikai eredmények tiszta sejtes szarkóma ín és aponeuroses. Puha részek malignus melanoma. A rák genetikája és citogenetikája 52 (1): 101-6.
24. Bridge J és Travis J. 1992. Számos és szerkezeti kromoszómális rendellenességek jelentősége a tiszta sejtes szarkóma esetében. A rák genetikája és citogenetikája 64 (2): 104-6.
25. Wang WL, Mayordomo E, Zhang W, Hernandez VS, Tuvin D, Garcia L, Lev DC, Lazar AJ és López-Terrada D. 2009. EWSR1 / ATF1 és EWSR1 / CREB1 kiméra transzkriptumok detektálása és jellemzése szarkóma (puha részek melanoma). Modern patológia 22 (9): 1201-9.
26. Pacheco M, Horsman DE, Hayes MM, Clarkson PW és Huwait H. 2010. A kisméretű kerek sejtes tumor a kölcsönös transzlokációban: esetjelentés. citogenetika: 1-8.
27. Hantschke M, Mentzel T, Ru A. és Palmedo G. 2010. Cutaneous Clear Cell Sarcoma: 12 esetből származó klinikopatológiai, immunhisztokémiai és molekuláris analízis, kiemelve annak különbségét a bőrön át a melanoma. American Journal of Surgical Pathology 34 (2): 216-222.
28. Antonescu CR, Nafa K, Segal NH, Dal Cin P és Ladanyi M. 2006. EWS-CREB1: visszatérő variáns fúzió tiszta sejtes szarkómában – a gyomor-bél rendszeri elhelyezkedése és a melanocitikus differenciálódás hiánya. Klinikai rákkutatás12 (18): 5356-62.
29. Pierotti MA, Negri T, Brich S, Conca E, Bozzi F, Orsenigo M, Stacchiotti S. et al. 2011. A receptor tirozin-kináz út-analízise fényt vet fel a Clear-Cell Sarcoma és Metastatic Melanoma között. Gének, kromoszómák Rák000 (június): 1-16.
30. Panagopoulos I, Mertens F, Dêbiec-Rychter M, Isaksson M, Limon J, Kardas I., Domanski HA és mtsai. 2002. Az EWS / ATF1 fúziós gén molekuláris genetikai jellemzése az ín és az aponeurosis tiszta sejtes szarkómájában. Nemzetközi rákos folyóirat 99 (4): 560-7.
31. Jakubauskas A, Valceckiene V, Andrekute K, Seinin D, Kanopka A és Griskevicius L. 2011. Két új EWSR1 / ATF1 transzkriptum felfedezése négy kiméra transzkriptumban expresszáló tiszta sejtes szarkóma és kvantitatív értékelésük alapján.Kísérleti és molekuláris patológia 90 (2): 194-200. Elsevier Inc.
32. Lyle PL, Amato CM, Fitzpatrick JE és Robinson WA. 2008. gasztrointesztinális melanoma vagy világos sejtszarkóma? A korábban diagnosztizált malignus melanóma 7 esetének molekuláris értékelése. American Journal of Surgical Pathology 32 (6): 858-866.
33. Stamenkovic I, Riggi N, Cironi L, Provero P, Suva ML, Stehle JC, Baumer K és Guillou L. 2006. A FUS-CHOP fúziós fehérje expressziója primer mesenchymalis progenitor sejtekben a myxoid liposarcoma . Rákkutatás66 (14): 7016-23.
34. Romeo S és Dei Tos AP. Az EWSR1 transzlokációhoz társuló lágyrész-daganatok. Virchows Archiv 456 (2): 219-34.
35. Alex D és Lee KW. 2005. Az EWS onkoprotein RGG-dobozai elnyomják a transzkripciós aktivációs domének tartományát.Nukleinsav kutatás 33 (4): 1323-1331.
36. Lee KW. 2007. Ewings család onkoproteinek: részegek, rendetlenek és partnerek keresése. Cell kutatás 17 (4): 286-8.
37. Rual J-F, Venkatesan K, Hao T, Hirozane-Kishikawa T, Dricot A, Li N, Berriz GF, et al. 2005. Az emberi fehérje-fehérje interakciós hálózat proteome-skála térképe felé. Természet 437 (7062): 1173-8.
38. Hai T és Hartman MG. 2001. Az aktiváló transzkripciós faktor / cAMP reaktív elem molekuláris biológiája és nómenklatúrája transzkripciós faktorok: a transzkripciós faktor fehérjék és a homeosztázis aktiválása. Gén273 (1): 1-11.
39. Schütz G, Hummler E, Cole TJ, Blendy JA, Ganss R, Aguzzi A, Schmid W és Beermann F. 1994. CREB gén célzott mutációja: kompenzáció a CREB / ATF családban a transzkripciós faktorokban. Az Amerikai Egyesült Államok Nemzeti Tudományos Akadémiája 91 (12): 5647-51.
40. Shanware NP, Zhan L, Hutchinson JA, Kim SH, Williams LM és Tibbetts RS. A CREB / ATF transzkripciós faktor szabályozása PP2A / B56gamma és genotoxikus stressz révén. PloS egyet 5 (8): e12173.
41. Reddy ES, Fujimura Y, Siddique H, Lee L és Rao VN. 2001. EWS-ATF-1 kiméra fehérje lágyszöveti sejtekben a szarkóma társítja a CREB-kötő fehérjét és interferál a p53-mediált transzaktiváló funkcióval. Onkogén 20 (46): 6653-9.
42. Schaefer K-L, Brachwitz K, Wai DH, Braun Y, Diallo R, Korsching E, Eisenacher M, et al. A lágyszövet-sejtvonalak t (12; 22) pozitív, egyértelmű sejtszarkóma expressziós profilja a potenciális új markergének, köztük az ERBB3 jellemző felszaporodását mutatja. Rákkutatás 64 (10): 3395-405.
43. Araya N, Hirota K, Shimamoto Y, Miyagishi M, Yoshida E, Ishida J, Kaneko S, Kaneko M, Nakajima T és Fukamizu A. 2003. Az EWS és a CREB kötő fehérje együttes kölcsönhatása szelektíven aktiválja a hepatocita nukleáris faktort közvetített transzkripció. A biológiai kémiai folyóirat 278 (7): 5427-32.
44. Wei L, Jamonnak N, Choy J, Wang Z és Zheng W. 2008. A CREB-kötő fehérje (CBP) és a p300 acetilezett MyoD bromodomainjainak differenciális kötési módjai. Biokémiai és Biofizikai Kutatási Kommunikáció 368 (2): 279-284.
45. Hinrichs SH és Olsen RJ. Az EWS IQ domén foszforilációja szabályozza az EWS / ATF1 és EWS / FLI1 fúziós fehérjék transzkripciós aktivitását. Onkogén 20 (14): 1756-1764.
46. Su L, Jones KB, Pacheco M, Goytain A, Capecchi MR, Underhill TM, Nielsen TO, és mtsai. Az SS18-SSX fúziós onkoprotein komplex dekonstrukciója: a betegség kórtörténete és terápiája. Rákos sejt 21 (3): 333-347.
47. Su L, Cheng H, Sampaio AV, Nielsen TO és Underhill TM. 2010. EGR1-reaktiváció a hiszton-dezacetiláz inhibitorok által elősegíti a szinoviális szarkóma sejtek halálát a PTEN tumorszuppresszoron keresztül. Onkogén 29 (30): 4352-61.
48. Wang L, Gura A, Sun XJ, Zhao X, Perna F, Huang G, Hatlen MA, Vu L, Liu F, Xu H, Asai T, Xu H, Deblasio T, Menendez S, Voza F, Cole PA, Zhang J, Melnick A, Roeder RG NS. Az AML1-ETO leukemogén hatása a helyspecifikus lizin acetilációtól függ. Tudomány 333: 765-769.
49. Fisher DE, Davis IJ, Mcfadden AW, Zhang Y, Coxon A, Teresa L és Wagner AJ. 2011. A c-Met receptor tirozin-kináz azonosítása és liganduma, Hepatocyte Growth Factor terápiás célpontok világos sejtes szarkómában. Rákkutatás70 (2): 639-645.
50. Rossow KL és R. Janknecht 2001. Az Ewing’s Sarcoma Gene termékfüggvények transzkripciós aktivátorként Az Ewing szarkóma géntermékei mint transzkripciós aktivátor 1. Rákkutatás: 2690-2695.
51. Goding C, Li K, Goodall J, Liao S-K, Wang C-H, Lin Y-C, Hiraga H. és munkatársai. A melanocita indukáló faktor MITF stabilan expresszálódik az emberi tiszta sejt szarkóma sejtvonalaiban. Brit rákos folyóirat 89 (6): 1072-8.
52. Panagopoulos I, Hallor KH, Micci F, Meis-Kindblom JM, Kindblom L-G, Bacchini P, Mandahl N és Mertens F. 2007. Fúziós gének angiomatoid fibrous histiocytoma. Rákbetegek 251 (1): 158-63.
53. Antonescu CR, Cin PD, Nafa K, Teot LA, Surti U, Fletcher CD és Ladanyi M. 2007. EWSR1-CREB1 A predomináns génfúzió angiomatoid fibrous histiocytoma. Gének, kromoszómák Rák 1060 (augusztus): 1051-1060.
54. Az FDA News Release. 2006. Az FDA jóváhagyja az új kezelést a gasztrointesztinális és a vesekárosodásban. US Food and Drug Administration, Január
55. Miller K, Burstein H, Elias A, Rugo H, Cobleigh M, Pegram M, Eisenberg P, Collier M, Adams B és CM B. 2005. Az SU11248, multitélgetett receptor tirozin kináz inhibitor (TKI) , korábban kezelt metasztatikus emlőrákban (MBC) szenvedő betegeknél (pts). A klinikai onkológia folyóirata (ASCO éves ülései) 23:
56. Socinski MA, Novello S, Brahmer JR, Rosell R, Sanchez JM, Belani CP, Govindan R. et al. A szunitinib multicentrikus II. Fázisú vizsgálata korábban kezelt, előrehaladott nem kissejtes tüdőrákban. A klinikai onkológia lapja 26 (4): 650-6.
57. Stacchiotti S, Grosso F, Negri T, Palassini E, Morosi C, Pilotti S, Gronchi A és Casali PG. 2010. A szunitinib-malát tumornövekedése tiszta sejtes szarkóma esetén. Az onkológiai évkönyvek 21 (5): 1130-1.
58. Sleijfer S, Ray-Coquard I, Papai Z, Le Cesne A, Scurr M, Schöffski P, Collin F., et al. 2009. Pazopanib, multikinase angiogenezis inhibitor, relapszusos vagy refrakter fejlett lágyszöveti sarcomában szenvedő betegek körében: a rák-lágy szövet és a csontszarkóma csoport kutatása és kezelése európai szervezetének fázis II. Vizsgálata. A klinikai onkológia lapja27 (19): 3126-32.
59. Keir ST, Morton CL, Wu J, Kurmasheva RT, Houghton PJ és Smith MA. A Pazopanib multitest gátló kináz gátló induló tesztelése a gyermekkori preklinikai tesztprogrammal. Gyermek vér és rák:
60. Hosaka S, Horiuchi K, Yoda M, Nakayama R, Tohmonda T, Susa M, Nakamura M, Chiba K, Toyama Y és Morioka H. 2012. Egy új multi-kináz inhibitor pazopanib gátolja a szinoviális szarkóma sejtek növekedését a PI3K-AKT útvonalon. Ortopédiai Kutatókönyv:
61. ArQule. 2007. Az ARQ 197 2. fázisú vizsgálata Microphthalmia transzkripciós faktorhoz társult daganatokban. In: ClinicalTrials.gov [Internet]. Bethesda (MD): Nemzeti Orvostani Könyvtár (US).
62. EORTC és Pfizer. 2012. Kereszt-tumoros 2. fázisú klinikai vizsgálat A Crizotinib (PF-02341066) vizsgálata az ALK és / vagy MET (“CREATE”) Causal Alterations által indukált fejlett daganatos betegekben. In: ClinicalTrials.gov [Internet]. Bethesda (MD): Nemzeti Orvostani Könyvtár (US).
63. Li BX és Xiao X. 2009. A KIX-KID kölcsönhatás kis molekulájú inhibitorának felfedezése. Chembiochem 10 (17): 2721-4.
64. Legjobb JL, Amezcua CA, Mayr B, Flechner L, Murawsky CM, Emerson B, Zor T, Gardner KH és Montminy M. 2004. Kis molekulájú antagonisták azonosítása, amelyek gátolják az aktivátort: koaktivátor kölcsönhatás. Az Amerikai Egyesült Államok Nemzeti Tudományos Akadémiája 101 (51): 17622-7.
65. Liu S, Cheng H és Kwan W. 2008. A hiszton dezacetiláz inhibitorok indukálják a növekedés leállítását, az apoptózist és a differenciálódást tiszta sejtes szarkóma modellekben apoptózissal és differenciálódással tiszta sejtes szarkóma modellekben. Molecular Cancer Therapeutics: 1751-1761.
66. Piekarz RL, Frye R, Turner M, Wright JJ, Allen SL, Kirschbaum MH, Zain J. et al. 2009. II. Fázis II. Monoterápiás próba a hiszton deacetiláz gátló romidepsin monoterápiaként a bőr T-sejtes lymphoma esetén. A klinikai onkológia lapja 27 (32): 5410-7.
67. Whittaker SJ, Demierre M-F, Kim EJ, Rook AH, Lerner A, Duvic M, Scarisbrick J. et al. 2010. A romidepsin multicentrikus, nemzetközi, pivotális vizsgálata refrakter bőr T-sejtes lymphomában. A klinikai onkológia lapja28 (29): 4485-91.
68. Rákterápia-értékelési program. 2006. A mellékhatásokra vonatkozó közös terminológiai kritériumok v3.0 (CTCAE). 0-71.
69. Doetzlhofer A, Rotheneder H, Lagger G, Koranda M, Kurtev V, Brosch G, Wintersberger E. és Seiser C. 1999. Hiszton-dezacetiláz 1 reprezentálhatják a transzlációt kötéssel Sp1-hez. Molekuláris és celluláris biológia 19 (8): 5504-5511.
70. Lessnick SL, Owen LA és Kowalewski AA. Az EWS / FLI közvetíti a transzkripciós repressziót az NKX2.2-en keresztül onkogén transzformáció során Ewing-féle szarkóma során. PloS egyet 3 (4): e1965.
71. McCallion AS, Prasad MK, Reed X, Gorkin DU, Cronin JC, McAdow AR, Chain K. és mtsai. A SOX10 közvetlenül befolyásolja az ERBB3 transzkripciót egy intronikus idegi gerincfokozó segítségével. BMC fejlődési biológia 11 (1): 40. BioMed Központi Kft.
72. Fisher DE, Yokoyama S, Feige E, Poling LL, Levy C, Widlund HR, Khaled M és Kung AL. 2008. MITF-expresszió farmakológiai szuppressziója a HDAC-gátlókon keresztül a melanocytákban. Pigment sejt melanoma kutatás(Május): 457-463.
V9N3 ESUN Copyright © 2012 Liddy Shriver Szarkóma Kezdeményezés.
Tiszta sejtes szarkóma transzgenikus egérmodellei
egy ESUN Frissítés Garrett Barry és Torsten O. Nielsen, Ph.D.
Dr. Mario Capecchi (2007 Nobel-fokozatú orvosbiológus, Oliver Smithies és Martin Evans) molekuláris genetikus úttörő munkájának köszönhetően technikákat dolgoztak ki a transzgenikus betegségmodellek létrehozására, amelyek során az egér embrióban kiválasztott bármely gén aktiválható , törölve vagy kicserélve. Ezek a technikák fontosak a gének sejtes és onkogén funkcióinak feltárásában in vivo, egész élő organizmusokban, szemben a sejttenyészetekben, ahol a sejtek rendkívül mesterséges környezetben élnek.
A transzgenikus egérmodulok megértése
A transzgenikus egérmodellek fontos forrást jelentenek az orvosbiológiai kutatók számára a pre-klinikai betegség vizsgálata során.A transzgenikus utal arra a tényre, hogy ezek a szervezetek “külső” genetikai anyagot vezettek be. A tudósok transzgenikus egereket hoznak létre a genetikai anyag tervezése és beillesztése során a korai egér embrió embrionális őssejtjeibe. Ezzel az eljárással a szelektív tenyésztési eljárás révén a tudósok az egereket megtervezhetik a bevezetett genetikai anyaggal, amelyet elosztanak minden sejtje számára. Dr.. Capecchi, Smithies és Evans kifejlesztették a genetikai anyag egyéni tervezésének kiegészítő módszereit, amelyek – az előzőekben ismertetett módon – az egérbe bejuttathatnak bizonyos genetikai betegségeket, például a rákot. Ezeket a tervezett genetikai rendszereket különböző kontextusokban használják: (1) az érdekes gének deaktiválására, (2) egy gén cseréjét egy másikra, vagy (3) aktiválják egy érdekes gént a szervezet fejlődésének bármely szakaszában. Lényegében ezek a módszerek lehetővé teszik a kutatók számára, hogy “gerjesztik a kapcsolókat” az érdekes gének számára, és megfigyeljék az eredményt egy olyan élő rendszerben, amely hasonló az emberhez (molekuláris és celluláris szinten). Ez a folyamat segítséget nyújt az emberi egér onkogéneknek az élő egerekben játszott funkciójával kapcsolatos kérdések megválaszolásában mint modellként az emberi rákban.
A közelmúltban két különböző kutatócsoport hozta létre és tette közzé a transzgenikus egérmodelleket a tiszta sejtes szarkóma esetében. Mind Yamada et al. és Straessler et al. (ez utóbbi a Dr. Capecchi csoportot képviselte) bevezették a kábítószer- és lineage marker-indukálható expresszióját EWSR1 / ATF1 transzgenikus egerekbe, feltételes expressziós technológiával. Azt találták, hogy a fúziós onkoprotein expressziója ezeknél az egereknél három hétig halálos volt, miután a fúziós onkoprotein pontmutációja olyan tumorok kifejlődéséhez vezetett, amelyek az emberi tiszta sejt szarkóma szövettani és immunhisztokémiai profilját összegezték. A tumorfejlődés kedvelt bizonyos anatómiai helyeket, például a végtagokat, a bordacsontot és az arcszöveteket, és a mezenhimális szöveti rekeszekben jött létre, összhangban az emberi tiszta sejtek szarkóma klinikai eredményeivel. Straessler et al. megvizsgálták egérmodell tumorainak expressziós profilját, és megállapította, hogy nagyon hasonlóak a homológ humán tiszta sejt szarkóma expressziós adatokhoz. Mindkét csoport megpróbálta felhasználni modelljeiket a tiszta sejtszarkóma valószínű eredetű sejtjének azonosítására. A két egér modell között fontos különbség a feltételes módszer EWSR1 / ATF1 kifejezést és hatalmát a kérdés megválaszolására. Yamada et al. helyezzük a fúziós onkogént a génaktiválás egy drogfüggő mechanizmusának irányítása alatt. Straessler et al. használjon egy erős Cre-Lox rekombinációs rendszert, amelynek segítségével EWSR1 / ATF1 expresszióját blokkolja egy loxP szegélyezett szekvencia, amelyet Cre rekombináz eltávolít. Ennek a módszernek az az előnye, hogy képesek a Cre rekombináz gént különféle szár- és progenitor sejt- és szövetspecifikus promoterek, valamint drogfüggő promóterek szabályozása alatt elhelyezni a részletes vonalkövetéshez. Yamada et al. azt találták, hogy tumor tömegeket fejeznek ki EWSR1 / ATF1 szintén Wnt1 és P0 promotor aktivitású neurális gerinc marker volt, ami azt sugallja, hogy a betegség neurális gerincsejtekből származik. Összehasonlításképpen, Straessler et al. még részletesebb vonalkövető kísérleteket használt az indukált hatások meghatározására EWSR1 / ATF1 a mesenchymalis sejtek expresszióját a szeletektől a progenitor állapotokig terjedő differenciálódási spektrummal szemben. Megállapították, hogy a mesenchymalis szár és a progenitor sejtek mindegyike tiszta sejtes szarkóma-szerű daganatok kialakulását eredményezte, mégis különbség volt az MITF és más markerek expressziójában, ami az emberi tiszta sejtek szarkóma változó klinikai bemutatásának lehetséges molekuláris okát sugallja. A Yamada tanulmánya et al. hogy az proto-onkogén Fos az EWSR1 / ATF1 fúziós onkoprotein közvetlen célpontja, és erősen szabályozódik a tiszta sejtszérumban. Ez egy ígéretes felfedezés, amely megnyitja az utat az új célzott terápiás stratégiák számára a jövőben.
Végeredményben mindkét egérmodell a tiszta sejtek sarcomagenesisének fontos új forrásként szolgál majd a betegség alapvető biológiájának jövőbeni kutatásához, új terápiás célok azonosításához és klinikai platformként szolgál a kísérleti terápiák tesztelésére olyan módon, biztonságos és költséghatékony.
1. Yamada K, Ohno T, Aoki H, Semi K, Watanabe A, Moritake H, Shiozawa S. et al. 2013. Az EWS / ATF1 expressziója egerekből származó neurális crest eredetű sejtekből származó szarkómákat indukál. Journal of Clinical Investigation 123 (2): 600-310.
2. Straessler KM, Jones KB, Hu H, Jin H, van Rijn M és Capecchi MR. 2013. Tiszta sejtes sarcomagenesis modellezése az egérben: az eredetű sejtek differenciálódási állapota befolyásolja a tumor jellemzőit. Rákos sejt 23 (2): 215-27.
V10N2 ESUN Copyright © 2013 Liddy Shriver Szarkóma Kezdeményezés.

Kommentek
Kommenteléshez kérlek, jelentkezz be: